Обобщенные научные материалы по действующему веществу препарата Золгенсма® (раствор для инфузий, 2×10^13 вектор-геномов/мл)
Дата последней актуализации: 17.01.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Противопоказания
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Отзывы
Действующее вещество
ATX
Владелец РУ
Новартис Фарма
Условия хранения
При температуре не выше -60 °C в оригинальной упаковке (пачка картонная).
Хранить в недоступном для детей месте.
Срок годности
1 год.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
rxlist.com, 2021.
Фармакологическая группа
Характеристика
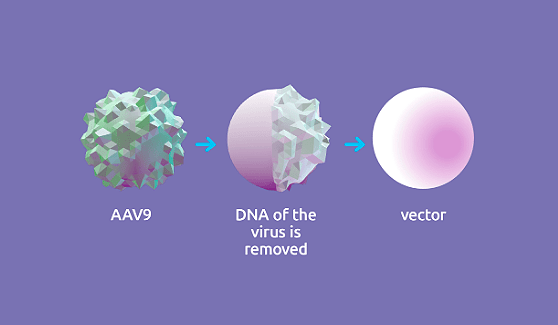
Онасемногена абепарвовек — суспензия для в/в инфузии, содержащая аденовирусассоциированный векторный препарат для генной терапии. Это рекомбинантный самокомплементарный AAV9, содержащий трансген, кодирующий белок, обеспечивающий выживание мотонейронов человека (SMN), под контролем гибридного промотора энхансера цитомегаловируса/куриного β-актина.
Фармакология
Механизм действия
Онасемноген абепарвовек — это рекомбинантная генная терапия на основе AAV9, разработанная для доставки копии гена, кодирующего человеческий белок SMN. Причиной спинальной мышечной атрофии (СМА) является биаллельная мутация гена SMN1, что приводит к недостаточной экспрессии белка SMN. В/в введение онасемногена абепарвовека, которое приводит к клеточной трансдукции и экспрессии белка SMN, наблюдалось в двух исследованиях у людей (см. Фармакокинетика).
Фармакодинамика
Клинически значимых данных о фармакодинамике онасемногена абепарвовека нет.
Фармакокинетика
Выделение вектора после инфузии онасемногена абепарвовека исследовали в нескольких временных точках в ходе завершенного клинического испытания. Образцы слюны, мочи и кала собирали на следующий день после инфузии, еженедельно до 30-го дня, а затем ежемесячно до 12-го месяца и каждые 3 мес после этого. Образцы от 5 пациентов были использованы для анализа выделения ДНК вектора онасемногена абепарвовека во время визита в 18 мес.
Векторная ДНК выделялась в слюне, моче и кале после инфузии, причем в кале обнаруживались гораздо более высокие концентрации векторной ДНК, чем в слюне или моче. Концентрация векторной ДНК в слюне была низкой в 1-й день после инфузии и снижалась до неопределяемых уровней в течение 3 нед. В моче концентрация векторной ДНК была очень низкой в 1-й день после инфузии и снижалась до неопределяемых уровней в течение 1–2 нед. В кале концентрация векторной ДНК была намного выше, чем в слюне или моче, в течение 1–2 нед после инфузии и снижалась до неопределяемых уровней через 1–2 мес после инфузии.
Биораспределение оценивалось у двух пациентов, которые умерли через 5,7 и 1,7 мес соответственно после инфузии онасемногена абепарвовека в дозе 1,1·1014 вектор-геномов (вг)/кг. В обоих случаях самые высокие уровни векторной ДНК были обнаружены в печени. Векторная ДНК была также обнаружена в селезенке, сердце, поджелудочной железе, паховых лимфатических узлах, скелетных мышцах, периферических нервах, почках, легких, кишечнике, спинном мозге, головном мозге и тимусе. Иммуноокрашивание на белок SMN показало генерализованную экспрессию SMN в мотонейронах спинного мозга, нейронах и глиальных клетках головного мозга, а также в сердце, печени, скелетных мышцах и других оцениваемых тканях.
Доклиническая токсикология
Канцерогенность, мутагенность, вляние на фертильность
Исследования у животных для оценки канцерогенности, мутагенности и влияния на фертильность для онасемногена абепарвовека не проводили.
Фармакология и/или токсикология у животных
В токсикологических исследованиях, проведенных у неонатальных мышей, наблюдалась дозозависимая сердечная и печеночная токсичность после в/в введения онасемногена абепарвовека. Связанные с онасемногена абепарвовеком изменения в миокарде при дозах 7,9·1013 вг/кг и выше включали воспалительные изменения небольшой или умеренной выраженности с преобладанием мононуклеарных клеток, сопровождающиеся отеком, фиброзом от легкой до средней степени выраженности, и разрозненную дегенерацию/регенерацию клеток миокарда. Дополнительные кардиологические изменения при уровнях доз 1,5·1014 вг/кг и выше включали тромбоз предсердий от легкого до умеренного и дилатацию предсердий от легкой до заметной. Результаты исследования печени включали гепатоцеллюлярную гипертрофию, активацию клеток Купфера, перинуклеарную вакуолизацию и разрозненный гепатоцеллюлярный некроз. Токсичность для органов-мишеней, сердца и печени, была ассоциирована со смертностью при уровнях доз 2,4·1014 вг/кг и выше, что примерно в 2,2 раза выше, чем рекомендованный уровень клинической дозы.
Клинические исследования
Эффективность онасемногена абепарвовека у педиатрических пациентов в возрасте до 2 лет со СМА с биаллельными мутациями в гене SMN1 оценивалась в открытом несравнительном клиническом испытании (продолжающемся) и открытом несравнительном клиническом испытании с возрастающей дозой (завершенном). У пациентов возникли клинические симптомы, соответствующие СМА, в возрасте до 6 мес. У всех пациентов были генетически подтвержденные биаллельные делеции гена SMN1, 2 копии гена SMN2 и отсутствие модификации c.859G>C в экзоне 7 гена SMN2 (что прогнозирует менее выраженный фенотип). Все пациенты имели исходные титры анти-AAV9 антител ≤1:50, измеренные с помощью ELISE. В обоих исследованиях онасемногена абепарвовек вводили в виде однократной в/в инфузии.
Эффективность была установлена на основе выживаемости и улучшения в развитии моторики, такого как сидение без опоры. Выживаемость определялась как время от рождения до смерти или постоянной вентиляции легких. Постоянная вентиляция определялась как требующая инвазивной вентиляции (трахеостомия) или респираторной поддержки в течение 16 или более часов в день (включая неинвазивную вентиляционную поддержку) непрерывно в течение 14 или более дней при отсутствии острого обратимого заболевания, за исключением периоперационной вентиляции. Эффективность также была подтверждена по оценке использования аппарата ИВЛ, нутриционной поддержки и оценкой по Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders (тест детской больницы Филадельфии для оценки двигательных функций пациентов с нервно-мышечными заболеваниями, CHOP-INTEND). CHOP-INTEND используется для оценки двигательной функции у пациентов с манифестацией СМА с младенческого возраста.
В продолжающееся клиническое исследование был включен 21 пациент (10 мальчиков и 11 девочек) с младенческим типом СМА. До лечения онасемногена абепарвовеком ни одному из 21 пациента не требовалась неинвазивная вентиляция легких (non-invasive ventilator, NIV), и все пациенты могли питаться исключительно перорально (т.е. не нуждались в непероральном питании). Средний балл по шкале CHOP-INTEND на исходном уровне составлял 31 (диапазон от 18 до 47). Все пациенты получили онасемногена абепарвовек 1,1·1014 вг/кг. Средний возраст 21 пациента на момент лечения составлял 3,9 мес (от 0,5 до 5,9 мес).
На момент среза данных для анализа в марте 2019 г. 19 пациентов были живы без постоянной вентиляции (т.е. бессобытийная выживаемость) и продолжали участие в исследовании, в то время как один пациент умер в возрасте 7,8 мес из-за прогрессирования заболевания, а один пациент выбыл из исследования в возрасте 11,9 мес. Возраст 19 выживших пациентов, продолжавших участие в исследовании, варьировал от 9,4 до 18,5 мес. К моменту среза данных 13 из 19 пациентов, продолжавших участие в исследовании, достигли 14-месячного возраста без постоянной вентиляции, одной из первичных конечных точек эффективности исследования. Помимо выживаемости, оценка другой из первичных конечных точек эффективности исследования показала, что 10 из 21 пациента (47,6%) достигли способности сидеть без поддержки в течение ≥30 с в возрасте от 9,2 до 16,9 мес (средний возраст составлял 12,1 мес). Исходя из естественного течения болезни, от пациентов, соответствующих критериям включения в исследование, нельзя было ожидать, что они смогут сидеть без опоры, и только примерно 25% этих пациентов, как можно было ожидать, выживут (т.е. будут живы без постоянной вентиляции) после 14 мес жизни. Кроме того, 16 из 19 пациентов не нуждались в ежедневном использовании NIV.
Сравнение результатов продолжающегося клинического испытания с доступными данными анамнеза пациентов с младенческим типом СМА является основным доказательством эффективности онасемногена абепарвовека.
В завершенное клиническое испытание было включено 15 пациентов (6 мальчиков и 9 девочек) с младенческим типом СМА, 3 в когорте низких доз и 12 в когорте высоких доз. На момент лечения средний возраст пациентов в группе низких доз составлял 6,3 мес (диапазон от 5,9 до 7,2 мес) и 3,4 мес (диапазон от 0,9 до 7,9 мес) в группе пациентов с высокими дозами. Доза, полученная пациентами из когорты низких доз, составляла примерно одну треть от дозы, полученной пациентами группы высоких доз. Однако точные дозы онасемногена абепарвовека, полученные пациентами в этом завершенном клиническом исследовании, неясны из-за изменения метода измерения концентрации онасемногена абепарвовека и снижения концентрации хранившегося препарата с течением времени. Ретроспективно оцененный диапазон доз в когорте высоких доз составляет приблизительно от 1,1·1014 до 1,4·1014вг/кг.
К 24 мес после инфузии онасемногена абепарвовека у одного пациента из когорты низких доз была достигнута конечная точка постоянной вентиляции; все 12 пациентов в группе, получавшей высокие дозы, были живы без постоянной вентиляции. Ни один из пациентов из когорты низких доз не мог сидеть без опоры, стоять или ходить; в когорте с высокими дозами 9 из 12 пациентов (75%) могли сидеть без опоры в течение ≥30 с, а 2 пациента (16,7%) могли стоять и ходить без посторонней помощи. Сравнение результатов пациентов когорты низких доз с результатами пациентов когорты высоких доз показывает зависимость доза–ответ, которая обеспечивает эффективность онасемногена абепарвовека.
Показания к применению
Онасемногена абепарвовек — это генная терапия на основе вектора аденоассоциированного вируса, показанная для лечения педиатрических пациентов в возрасте до 2 лет со спинальной мышечной атрофией с биаллельными мутациями в гене выживания мотонейронов 1 (SMN1).
Ограничение использования
Безопасность и эффективность повторного введения онасемногена абепарвовека не оценивали (см. «Побочные действия»).
Применение онасемногена абепарвовека у пациентов с прогрессирующей СМА (например, полный паралич конечностей, постоянная зависимость от ИВЛ) не оценивали (см. Клинические исследования).
Противопоказания
Нет.
Применение при беременности и кормлении грудью
Беременность
Резюме рисков. Нет доступных данных о применении онасемногена абепарвовека у беременных женщин. Исследования токсичности для репродуктивной системы и развития у животных с онасемногеном абепарвовеком не проводили.
Для населения США в целом оценочный фоновый риск серьезных врожденных дефектов и выкидыша при клинически признанных беременностях составляет от 2 до 4 и от 15 до 20% соответственно.
Грудное вскармливание
Резюме рисков. Нет информации о присутствии онасемногена абепарвовека в грудном молоке, воздействии его на грудного ребенка или влиянии на выработку молока. Следует учитывать преимущества грудного вскармливания для развития и здоровья, а также клиническую потребность матери в ЛС и любые потенциальные неблагоприятные воздействия онасемногена абепарвовека на грудного ребенка или основное состояние матери.
Побочные действия
Наиболее частыми побочными реакциями (частота ≥5%) было повышение уровня аминотрансфераз и рвота.
Опыт клинических испытаний
Поскольку клинические испытания проводятся с различным набором условий, частота встречаемости побочных реакций, наблюдаемых в этих испытаниях, не может непосредственно сравниваться с частотой в других клинических испытаниях и может не отражать наблюдаемую в клинической практике.
Данные по безопасности, представленные в этом разделе, отражают экспозицию онасемногена абепарвовека в четырех открытых исследованиях, проведенных в США, включая одно завершенное клиническое испытание, два продолжающихся клинических испытания и одно продолжающееся наблюдательное долгосрочное последующее исследование завершенного испытания. В общей сложности 44 пациента со СМА получили в/в инфузию онасемногена абепарвовека, 41 пациент — в рекомендованной дозе или выше и 3 пациента — в более низкой дозе. Возраст пациентов составлял от 0,3 до 7,9 мес на момент инфузии (диапазон массы тела от 3 до 8,4 кг).
Наиболее частые побочные реакции (частота ≥5%), наблюдавшиеся в 4 исследованиях, суммированы в таблице 1.
Таблица 1
Побочные реакции после лечения онасемногена абепарвовеком (n=44)
| Побочные реакции | Пациенты n (%) |
| Повышение уровня аминотрансфераз1,2 (>ВГН) | 12 (27,3%) |
| Рвота | 3 (6,8%) |
1 Повышение уровня аминотрансфераз включают повышение АЛТ и/или АСТ.
2 В завершенном клиническом исследовании один пациент (первый пациент, которому в этом исследовании была проведена инфузия) был включен до внесения поправки в протокол, предусматривающей введение преднизолона до и после инфузии онасемногена абепарвовека.
Один пациент в продолжающемся клиническом испытании за пределами США первоначально поступил с респираторной недостаточностью через 12 дней после инфузии онасемногена абепарвовека, и был обнаружен респираторно-синцитиальный вирус (RSV) и вирус парагриппа в респираторных секретах. У пациента были эпизоды серьезной гипотензии с последующими судорогами, а также лейкоэнцефалопатия (дефекты белого вещества головного мозга) примерно через 30 дней после инфузии онасемногена абепарвовека. Пациент умер после прекращения жизнеобеспечения через 52 дня после инфузии.
Иммуногенность
В клинических испытаниях онасемногена абепарвовека пациенты должны были иметь исходные титры антител к AAV9 ≤1:50, измеренные с помощью иммуноферментного анализа (ELISA). Доказательства предшествующей экспозиции AAV9 имелись редко. Безопасность и эффективность онасемногена абепарвовека у пациентов с титрами антител к AAV9 выше 1:50 не оценивали. Необходимо перед инфузией онасемногена абепарвовека провести тестирование на наличие антител к AAV9 на исходном уровне. Повторное тестирование может быть выполнено, если титры антител к AAV9 составляют >1:50.
После инфузии онасемногена абепарвовека у всех пациентов наблюдалось увеличение титров антител к AAV9 по сравнению с исходным уровнем. В завершенном клиническом исследовании титры антител к AAV9 достигли по крайней мере 1:102400 у каждого пациента, и титры превысили 1:819200 у большинства пациентов. Повторное введение онасемногена абепарвовека в присутствии высоких титров антител к AAV9 не было оценено.
Взаимодействие
По возможности следует скорректировать график вакцинации пациента с учетом сопутствующего введения кортикостероидов до и после инфузии онасемногена абепарвовека. Некоторые вакцины, такие как комбинированная вакцина против кори, краснухи и паротита и вакцина против ветряной оспы, противопоказаны пациентам, получающим в значительной степени иммуносупрессивные дозы стероидов (т.е. ≥2 нед ежедневного приема 20 мг или 2 мг/кг преднизона или его эквивалента). Сезонная профилактика против RSV не исключается.
Передозировка
Информация не предоставлена.
Способ применения и дозы
В/в. Только для однократной в/в инфузии.
Меры предосторожности
Острое серьезное поражение печени и повышение уровня аминотрансфераз
При применении онасемногена абепарвовека может возникнуть острое серьезное повреждение печени. До инфузии онасемногена абепарвовека у пациента с ранней манифестацией СМА были повышены уровни АСТ и АЛТ неустановленной этиологии (ГГТ, общий билирубин и ПВ были в пределах нормы). Пациент проходил лечение по программе расширенного доступа в США. Пациент получал кортикостероиды, эквивалентно пероральному преднизолону, в дозе 1 мг/кг/сут в течение примерно 30 дней с последующим 14-дневным снижением дозы. Примерно через 7 нед после применения онасемногена абепарвовека у пациента появилась желтуха. Лабораторные тесты соответствовали острому серьезному поражению печени с уровнем AСT приблизительно 80×ВГН и уровнем AЛT приблизительно 45×ВГН, общим билирубином приблизительно 4×ВГН и ПВ в плазме приблизительно 4×ВГН. Биопсия печени показала острую массивную дегенерацию гепатоцитов и массивный смешанный воспалительный инфильтрат (в основном CD8-положительные Т-лимфоциты). Состояние пациента восстановилось до исходного после лечения кортикостероидами.
Применение онасемногена абепарвовека может привести к повышению уровня трансаминаз. У двух (2/44) пациентов в клинических исследованиях после инфузии онасемногена абепарвовека уровень АСТ и АЛТ увеличился до 48×ВГН. Этих пациентов, у которых в других отношениях все было бессимптомным с нормальным уровнем общего билирубина, лечили системными кортикостероидами, и патологии разрешались без клинических последствий.
Перед инфузией онасемногена абепарвовека необходимо оценить функцию печени с помощью клинического обследования и лабораторных исследований (аминотрансферазы печени (АСТ и АЛТ), уровень общего билирубина и ПВ). Следует продолжать мониторинг функции печени в течение как минимум 3 мес после инфузии (еженедельно в течение первого месяца, а затем каждые две недели в течение второго и третьего месяцев, пока результаты не достигнут нормальных показателей).
Тромбоцитопения
Преходящее снижение количества тромбоцитов, в некоторых случаях соответствовавшее критериям тромбоцитопении, наблюдалось в разные моменты времени после инфузии онасемногена абепарвовека. Необходим мониторинг количества тромбоцитов перед инфузией и регулярно после нее (еженедельно в течение первого месяца; каждые две недели в течение второго и третьего месяцев, пока количество тромбоцитов не вернется к исходному уровню).
Повышение тропонина-I
В клинических испытаниях после инфузии онасемногена абепарвовека наблюдалось временное повышение уровня сердечного тропонина-I (до 0,176 мкг/л). Клиническая важность этих результатов неизвестна. Однако сердечная токсичность наблюдалась в исследованиях на животных (см. Фармакология и/или токсикология у животных). Необходим мониторинг тропонина-I перед инфузией онасемногена абепарвовека и на регулярной основе в течение не менее 3 мес после этого (еженедельно в течение первого месяца, а затем ежемесячно в течение второго и третьего месяцев, пока уровень тропонина-I не вернется к исходному уровню).
Применение в педиатрии
Применение онасемногена абепарвовека у недоношенных новорожденных до достижения ими возраста, соответствующего гестационному возрасту доношенного ребенка, не рекомендуется, поскольку сопутствующее лечение кортикостероидами может отрицательно повлиять на развитие нервной системы. Следует отложить инфузию до достижения соответствующего гестационному возраста.
Нет информации о том, следует ли ограничивать грудное вскармливание женщинам, которые могут быть серопозитивными на антитела к AAV9.
Безопасность онасемногена абепарвовека изучали у педиатрических пациентов, получавших инфузию в возрасте от 0,3 до 7,9 мес (диапазон массы тела от 3 до 8,4 кг) (см. «Побочные действия»).
Эффективность онасемногена абепарвовека изучали у педиатрических пациентов, которые получали инфузию в возрасте от 0,5 до 7,9 мес (диапазон массы тела от 3,6 до 8,4 кг) (см. Клинические исследования).
Нарушение функции печени
У одного пациента, получившего инфузию онасемногена абепарвовека, развилось острое серьезное поражение печени, у этого пациента были повышенные уровни аминотрансфераз до инфузии. В клинических испытаниях у пациентов после инфузии онасемногена абепарвовека наблюдалось повышение уровня аминотрансфераз (см. «Меры предосторожности»).
Золгенсма — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-007675
Торговое наименование:
Золгенсма
Международное непатентованное или группировочное наименование:
онасемноген абепарвовек.
Лекарственная форма:
раствор для инфузий.
Состав:
1 мл препарата содержит:
действующее вещество: онасемноген абепарвовек 2,0×1013 вектор-геномов (вг);
вспомогательные вещества: трометамин, магния хлорид, натрия хлорид, полоксамер 188, хлористоводородная кислота, вода для инъекций.
Описание:
От прозрачного до слегка опалесцирующего, от бесцветного до слегка белого цвета раствор.
Фармакотерапевтическая группа:
прочие препараты для лечения заболеваний костно-мышечной системы.
Код АТХ:
М09АХ09
Фармакологические свойства
Механизм действия
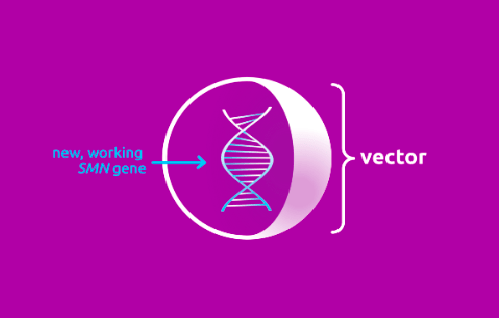
Онасемноген абепарвовек – это генотерапевтический препарат, предназначенный для введения функциональной копии гена выживания моторных нейронов 1 (SMN1) в трансдуцированные клетки для устранения моногенной первопричины спинальной мышечной атрофии (СМА). Ожидается, что благодаря внедрению в моторные нейроны альтернативного источника экспрессии белка SMN, препарат обеспечит выживание и корректное функционирование трансдуцированных моторных нейронов.
Онасемноген абепарвовек представляет собой не реплицирующийся рекомбинантный аденоассоциированный вирусный (AAV) вектор, который использует капсид аденоассоциированного вируса серотипа 9 (AAV9) для доставки стабильного, полностью функционального трансгена человеческого SMN. Установлено, что капсид AAV9 способен проникать через гематоэнцефалический барьер и трансдуцировать моторные нейроны. Ген SMN1, содержащийся в онасемноген абепарвовеке, предназначен для того, чтобы персистировать в ядре трансдуцированных клеток в виде эписомальной ДНК, ожидается, что он будет стабильно экспрессироваться на протяжении длительного времени в постмитотических клетках. Способность вируса AAV9 вызывать заболевание у человека неизвестна. Трансген вводится в клетки-мишени в виде самокомплементарной двухцепочечной молекулы. Экспрессия трансгена регулируется конститутивным промотором (гибрид промотора гена куриного β-актина и энхансера транскрипции цитомегаловируса), который обеспечивает постоянную и устойчивую экспрессию белка SMN. Описанный механизм действия подкреплен данными доклинических исследований и данными по биораспределению в организме человека.
Фармакодинамика
Фармакодинамические исследования не применимы для препаратов генной терапии.
Фармакокинетика
Распределение
Оценка биораспределения была проведена у двух пациентов, которые умерли через 5,7 и 1,7 месяцев соответственно после инфузии препарата онасемноген абепарвовека в дозе 1,1×1014 вг/кг. В обоих случаях максимальное содержание векторной ДНК было обнаружено в печени. Векторная ДНК была также обнаружена в селезенке, сердце, поджелудочной железе, паховых лимфатических узлах, скелетных мышцах, периферических нейронах, почках, легких, кишечнике, гонадах, спинном мозге, головном мозге и тимусе. Иммунное окрашивание на белок SMN выявило генерализованную экспрессию SMN в моторных нейронах спинного мозга, нейронах и глиальных клетках головного мозга, а также в сердце, печени, скелетных мышцах и других изученных тканях.
Элиминация
Исследования выделения вектора онасемноген абепарвовека оценивали количество вектора, выводимого из организма со слюной, мочой и калом.
Онасемноген абепарвовек обнаруживался в биологическом материале в постинфузионном периоде. Онасемноген абепарвовек выводился главным образом с калом, причем основная часть препарата выводилась в течение 30 дней после его применения.
Показания к применению
Препарат показан для применения у:
- пациентов со спинальной мышечной атрофией (СМА) с биаллельной мутацией в гене SMN1 и клиническим диагнозом СМА 1-го типа или
- пациентов со СМА с биаллельной мутацией гена SMN1 и не более чем с тремя копиями гена SMN2.
Противопоказания
Гиперчувствительность к онасемноген абепарвовеку или к любому из вспомогательных веществ.
С осторожностью
Следует соблюдать осторожность при применении препарата Золгенсма у пациентов с нарушениями функции почек, с нарушениями функции печени (в частности, у пациентов с повышенной концентрацией билирубина, не связанной с желтухой новорожденных), у недоношенных новорожденных до достижения ими возраста, соответствующего гестационному возрасту доношенного ребенка.
Применение при беременности и в период грудного вскармливания
Данные о применении препарата Золгенсма в период беременности или лактации отсутствуют. В исследованиях репродуктивной и эмбриофетальной токсичности у животных препарат Золгенсма не изучался.
Способ применения и дозы
Лечение должно начинаться и проводиться в клинических центрах под наблюдением врача, имеющего опыт ведения пациентов со СМА.
Перед применением препарата Золгенсма необходимо провести следующие лабораторные исследования:
- тест на определение содержания антител к AAV9 с использованием соответствующего валидированного метода исследования;
- оценка функции печени: определение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) и концентрации общего билирубина;
- клинический анализ крови (включая концентрацию гемоглобина и количество тромбоцитов);
- тест на тропонин I;
- оценка концентрации креатинина.
Необходимость тщательного мониторинга функции печени, количества тромбоцитов и концентрации тропонина I после инфузии, а также необходимость назначения терапии глюкокортикостероидами должны учитываться при определении сроков лечения онасемноген абепарвовеком (см. раздел «Особые указания»).
В случае острых или хронических неконтролируемых активных инфекций лечение следует отложить до тех пор, пока инфекция не разрешится или не будет контролироваться (см. раздел «Особые указания»).
Режим дозирования
Препарат Золгенсма предназначен только для однократной внутривенной инфузии.
Номинальная доза онасемноген абепарвовека, которую получит пациент, составляет 1,1×1014 вг/кг. Общий вводимый объем препарата Золгенсма определяется массой тела пациента, согласно информации, указанной в таблице 1.
Таблица 1 содержит рекомендуемые дозы для пациентов с массой тела от 2,6 до 21,0 кг.
Таблица 1. Рекомендуемые дозы в зависимости от массы тела пациента
| Диапазон массы тела пациента (кг) | Доза (вг) | Общий вводимый объем1 (мл) |
| 2,6-3,0 | 3,3×1014 | 16,5 |
| 3,1-3,5 | 3,9×1014 | 19,3 |
| 3,6-4,0 | 4,4×1014 | 22,0 |
| 4,1-4,5 | 5,0×1014 | 24,8 |
| 4,6-5,0 | 5,5×1014 | 27,5 |
| 5,1-5,5 | 6,1×1014 | 30,3 |
| 5,6-6,0 | 6,6×1014 | 33,0 |
| 6,1-6,5 | 7,2×1014 | 35,8 |
| 6,6-7,0 | 7,7×1014 | 38,5 |
| 7,1-7,5 | 8,3×1014 | 41,3 |
| 7,6-8,0 | 8,8×1014 | 44,0 |
| 8,1-8,5 | 9,4×1014 | 46,8 |
| 8,6-9,0 | 9,9×1014 | 49,5 |
| 9,1-9,5 | 1,05×1015 | 52,3 |
| 9,6-10,0 | 1,10×1015 | 55,0 |
| 10,1-10,5 | 1,16×1015 | 57,8 |
| 10,6-11,0 | 1,21×1015 | 60,5 |
| 11,1-11,5 | 1,27×1015 | 63,3 |
| 11,6-12,0 | 1,32×1015 | 66,0 |
| 12,1-12,5 | 1,38×1015 | 68,8 |
| 12,6-13,0 | 1,43×1015 | 71,5 |
| 13,1-13,5 | 1,49×1015 | 74,3 |
| 13,6-14,0 | 1,54×1015 | 77,0 |
| 14,1-14,5 | 1,60×1015 | 79,8 |
| 14,6-15,0 | 1,65×1015 | 82,5 |
| 15,1-15,5 | 1,71×1015 | 85,3 |
| 15,6-16,0 | 1,76×1015 | 88,0 |
| 16,1-16,5 | 1,82×1015 | 90,8 |
| 16,6-17,0 | 1,87×1015 | 93,5 |
| 17,1-17,5 | 1,93×1015 | 96,3 |
| 17,6-18,0 | 1,98×1015 | 99,0 |
| 18,1-18,5 | 2,04×1015 | 101,8 |
| 18,6-19,0 | 2,09×1015 | 104,5 |
| 19,1-19,5 | 2,15×1015 | 107,3 |
| 19,6-20,0 | 2,20×1015 | 110,0 |
| 20,1-20,5 | 2,26×1015 | 112,8 |
| 20,6-21,0 | 2,31×1015 | 115,5 |
1 – количество флаконов в наборе и необходимое количество наборов зависит от массы тела пациента; объем дозы рассчитан исходя из верхней границы диапазона массы тела пациента
Доза онасемноген абепарвовека и точное количество флаконов, необходимых для каждого пациента, рассчитывается в зависимости от массы тела пациента (см. таблицу 1 и таблицу 2).
Таблица 2. Варианты конфигурации упаковки
| Масса тела пациента (кг) | Флакон объемом 5,5 млa | Флакон объемом 8,3 млb | Общее количество флаконов в упаковке |
| 2,6-3,0 | 0 | 2 | 2 |
| 3,1-3,5 | 2 | 1 | 3 |
| 3,6-4,0 | 1 | 2 | 3 |
| 4,1-4,5 | 0 | 3 | 3 |
| 4,6-5,0 | 2 | 2 | 4 |
| 5,1-5,5 | 1 | 3 | 4 |
| 5,6-6,0 | 0 | 4 | 4 |
| 6,1-6,5 | 2 | 3 | 5 |
| 6,6-7,0 | 1 | 4 | 5 |
| 7,1-7,5 | 0 | 5 | 5 |
| 7,6-8,0 | 2 | 4 | 6 |
| 8,1-8,5 | 1 | 5 | 6 |
| 8.6-9.0 | 0 | 6 | 6 |
| 9,1-9,5 | 2 | 5 | 7 |
| 9,6-10,0 | 1 | 6 | 7 |
| 10,1-10,5 | 0 | 7 | 7 |
| 10,6-11,0 | 2 | 6 | 8 |
| 11,1-11,5 | 1 | 7 | 8 |
| 11,6-12,0 | 0 | 8 | 8 |
| 12,1-12,5 | 2 | 7 | 9 |
| 12,6-13,0 | 1 | 8 | 9 |
| 13,1-13,5 | 0 | 9 | 9 |
| 13,6-14,0 | 2 | 8 | 10 |
| 14,1-14,5 | 1 | 9 | 10 |
| 14,6-15,0 | 0 | 10 | 10 |
| 15,1-15,5 | 2 | 9 | 11 |
| 15,6-16,0 | 1 | 10 | 11 |
| 16,1-16,5 | 0 | 11 | 11 |
| 16,6-17,0 | 2 | 10 | 12 |
| 17,1-7,5 | 1 | 11 | 12 |
| 17,6-18,0 | 0 | 12 | 12 |
| 18,1-18,5 | 2 | 11 | 13 |
| 18,6-19,0 | 1 | 12 | 13 |
| 19,1-19,5 | 0 | 13 | 13 |
| 19,6-20,0 | 2 | 12 | 14 |
| 20,1-20,5 | 1 | 13 | 14 |
| 20,6-21,0 | 0 | 14 | 14 |
a – Номинальная концентрация во флаконе – 2×1013 вг/мл, извлекаемый объем не менее 5,5 мл.
b – номинальная концентрация во флаконе – 2×1013 вг/мл, извлекаемый объем не менее 8,3 мл.
Иммуномодулирующая терапия
После инфузии препарата Золгенсма у пациентов будет возникать иммунный ответ на капсидные белки вектора на основе аденоассоциированного вируса серотипа 9 (AAV9) (см. раздел «Особые указания»). Это может привести к повышению активности печеночных трансаминаз, повышению концентрации тропонина I или снижению количества тромбоцитов (см. разделы «Побочное действие» и «Особые указания»). Для ослабления иммунного ответа рекомендуется иммуномодуляция глюкокортикостероидами. По возможности график вакцинации пациента следует скорректировать с учетом сопутствующего применения глюкокортикостероидов в пре- и постинфузионном периоде применения препарата Золгенсма (см. раздел «Взаимодействие с другими лекарственными препаратами»).
До начала иммуномодулирующей терапии и до введения препарата Золгенсма пациент должен быть обследован на наличие признаков активного инфекционного заболевания любой этиологии.
За 24 часа до инфузии онасемноген абепарвовека рекомендуется начать иммуномодулирующую терапию в соответствии с графиком, приведенным в таблице 3. Отклонения от этих рекомендаций остаются на усмотрение лечащего врача (см. раздел «Особые указания»).
Таблица 3. Иммуномодулирующий режим в пре- и постинфузионном периоде применения препарата Золгенсма
| Преинфузионный период | За 24 часа инфузии препарата Золгенсма | Преднизолон перорально из расчета 1 мг/кг/сут (или эквивалентная доза другого глюкокортикостероида) |
| Постинфузионный период | В течение 30 дней после инфузии препарата Золгенсма (включая день инфузии) | Преднизолон перорально из расчета 1 мг/кг/сут (или эквивалентная доза другого глюкокортикостероида) |
| В течение следующих 28 дней | Дозу системного глюкокортикостероида следует снижать постепенно, не следует резко прекращать терапию данными препаратами. | |
| Для пациентов с незначительными изменениями (клинические показатели в пределах нормы; концентрация общего билирубина, активность АЛТ и ACT ниже 2×ВГН (верхняя граница нормы) по окончании 30-дневного периода). | Постепенное снижение дозы преднизолона (или эквивалентной дозы другого глюкокортикостероида), например, в течение 2 недель по 0,5 мг/кг/сут, затем 2 недели по 0,25 мг/кг/сут. | |
| Или Для пациентов с нарушением функции печени по окончании 30-дневного постинфузионного периода: продолжить терапию, пока активность АЛТ и ACT не снизятся до уровня ниже 2×ВГН, а другие показатели не вернутся в нормальные диапазоны, после чего следует постепенно снижать дозу глюкокортикостероида в течение следующих 28 дней или более при необходимости. |
Системные глюкокортикостероиды (эквивалентно преднизолону перорально из расчета 1 мг/кг/сут). Дозу системного глюкокортикостероида следует снижать постепенно, не следует резко прекращать терапию данными препаратами. |
|
| Функцию печени следует контролировать как минимум в течение 3 месяцев после инфузии препарата Золгенсма (см. раздел «Особые указания»). |
При отсутствии адекватного ответа на терапию глюкокортикостероидом в дозе, эквивалентной пероральной дозе преднизолона 1 мг/кг/сут, следует проконсультировать пациента у детского гастроэнтеролога или гепатолога. При непереносимости глюкокортикостероидов при их приеме внутрь, может быть рассмотрено внутривенное введение (см. раздел «Особые указания»).
В случае применения альтернативного глюкокортикостероида вместо преднизолона лечащему врачу следует руководствоваться вышеизложенными принципами терапии с использованием того же подхода к постепенному снижению дозы по прошествии 30 дней после инфузии препарата Золгенсма.
Особые группы пациентов
Пациенты с нарушениями функции почек
Безопасность и эффективность препарата Золгенсма у пациентов данной группы не установлены. Следует соблюдать осторожность при рассмотрении вопроса о применении препарата Золгенсма у пациентов данной группы. Коррекция дозы препарата не требуется.
Пациенты с нарушениями функции печени
В клинических исследованиях не изучено применение препарата у пациентов с активностью ACT и АЛТ или общей концентрацией билирубина (за исключением обусловленной желтухой новорожденных) более чем в 2 раза превышающих ВГН. Следует соблюдать осторожность при рассмотрении вопроса о применении препарата Золгенсма у пациентов с нарушением функции печени (см. разделы «Особые указания» и «Побочное действие»). Коррекция дозы препарата не требуется.
Генотип 0SMN1/1SMN2
У пациентов с биаллельной мутацией в гене SMN1 и одной копией гена SMN2 коррекция дозы препарата не требуется.
Анти-ААV9 антитела
Не требуется коррекция дозы у пациентов с исходным титром анти-ААУ9 антител превышающем 1:50 (см. раздел «Особые указания»).
Пациенты в возрасте младше 18 лет
Безопасность и эффективность онасемноген абепарвовека у недоношенных новорожденных до достижения полного гестационного возраста не установлены. Данные по применению препарата у данной категории пациентов отсутствуют. Следует тщательно оценить возможность применения препарата в связи с возможным негативным влиянием глюкокортикостероидов на их неврологическое развитие.
Опыт применения препарата у пациентов 2 лет и старше или с массой тела выше 13,5 кг ограничен. Безопасность и эффективность онасемноген абепарвовека у данной группы пациентов не установлены.
Способ применения
Препарат Золгенсма предназначен исключительно для однократной внутривенной инфузии с использованием инфузионного шприцевого насоса.
Меры предосторожности при применении
Препарат Золгенсма содержит генетически модифицированные вирусные частицы. При обращении с препаратом необходимо соблюдать следующие меры предосторожности:
- Подготовку препарата к инфузии следует проводить с соблюдением правил асептики.
- Следует использовать средства индивидуальной защиты (включая перчатки, защитные очки, лабораторный халат и нарукавники) во время подготовки препарата и последующей его инфузии. При наличии порезов или царапин на коже медицинскому персоналу не следует проводить каких-либо манипуляций с препаратом.
- Пролитую часть препарата следует убрать при помощи абсорбирующей марлевой салфетки, поверхность обработать дезинфицирующим раствором (хлорсодержащим), а затем спиртовыми салфетками.
- Все использованные для очистки средства следует утилизировать в двойном пакете в соответствии с требованиями по утилизации биологических отходов. Все материалы, которые могли быть в контакте с онасемноген абепарвовеком (например, флакон, все материалы, используемые для инфузии, включая стерильные салфетки и иглы), должны быть утилизированы в соответствии с требованиями по утилизации биологических отходов.
- Следует избегать случайного контакта с онасемноген абепарвовеком. При попадании на кожу пораженный участок следует тщательно промыть водой с мылом в течение не менее 15 минут. При попадании в глаза их необходимо тщательно промыть водой в течение не менее 15 минут.
Получение и размораживание флаконов
- Препарат транспортируется в условиях глубокой заморозки (≤ -60 °С). Немедленно после получения флаконы с препаратом в оригинальной упаковке необходимо поместить в холодильник с температурой 2 °С — 8 °С.
- Терапию препаратом Золгенсма необходимо провести в течение 14 дней с момента получения препарата.
- Перед введением препарат необходимо разморозить. Не используйте препарат Золгенсма до полного размораживания.
- После размораживания препарат необходимо извлечь из холодильника в день инфузии.
- Для размораживания набора до 9 флаконов в холодильнике требуется около 12 часов. Для размораживания набора до 14 флаконов в холодильнике требуется около 16 часов.
- Альтернативно при необходимости немедленного введения возможно размораживание препарата при комнатной температуре. Для размораживания набора до 9 флаконов при комнатной температуре (20 °С — 25 °С) требуется около 4 часов. Для размораживания набора до 14 флаконов при комнатной температуре (20 °С — 25 °С) требуется около 6 часов.
- Перед тем, как набрать необходимый объем препарата в шприц, аккуратно перемешайте раствор, осторожно вращая флакон. Не встряхивать.
- В случае изменения цвета или обнаружения перед введением каких-либо частиц в размороженном растворе, не используйте препарат.
- Непосредственно перед введением наберите полный объем дозы препарата в шприц. Перед в/в введением препарата необходимо удалить пузырьки воздуха из шприца. Препарат вводят при помощи инфузионного шприцевого насоса.
- После размораживания препарат необходимо ввести как можно раньше.
- Шприц, содержащий необходимый объем препарата, следует использовать в течение 8 часов. Если подготовленный шприц с раствором не использован в течение 8 часов, его следует утилизировать.
- Не замораживать повторно. Инструкция по проведению внутривенной инфузии
- Установите основной катетер в периферическую вену верхней или нижней конечности.
- Рекомендовано установить второй в/в («запасной») катетер на случай закупоривания основного катетера.
- Перед введением препарата шприцевой насос необходимо запрограммировать для промывки катетера физиологическим раствором либо выполнить это действие вручную.
- Препарат Золгенсма следует вводить внутривенно медленно в течение не менее 60 минут. Не вводите препарат путем быстрой внутривенной или болюсной инъекции.
- После завершения инфузии следует промыть инфузионную магистраль физиологическим раствором.
- Неиспользованный остаток препарата и все отходы следует утилизировать в соответствии с требованиями по утилизации биологических отходов.
Побочное действие
Резюме профиля безопасности
Безопасность препарата изучена в открытых клинических исследованиях у 99 пациентов, получивших препарат в рекомендованной дозе (1,1×1014 вг/кг). Наиболее частыми нежелательными реакциями (HP), отмечавшихся после инфузии препарата, были повышение активности печеночных трансаминаз (24,2%), гепатотоксичность (9,1%), рвота (8,1%) и пирексия (5,1%).
Табличные данные о нежелательных реакциях
HP, связанные с применением препарата, которые отмечены у всех пациентов, получивших внутривенную инфузию онасемноген абепарвовека, перечислены ниже. HP сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения частоты их встречаемости. Внутри каждой категории частоты HP представлены в порядке уменьшения степени их важности. Частота встречаемости оценивалась следующим образом: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100); редко (≥1/10000 и <1/1000); очень редко (<1/10000), частота неизвестна (невозможно оценить по имеющимся данным).
Таблица 4. Табличный перечень нежелательных реакций
| Нарушения со стороны крови и лимфатической системы | |
| Часто | Тромбоцитопения |
| Неизвестно | Тромботическая микроангиопатия1) |
| Нарушения со стороны желудочно-кишечного тракта | |
| Часто | Рвота |
| Нарушения со стороны печени и желчевыводящих путей | |
| Часто | Гепатотоксичность2) |
| Неизвестно | Острая печеночная недостаточность1) |
| Неизвестно | Острое поражение печени1) |
| Общие расстройства и нарушения в месте введения | |
| Часто | Пирексия |
| Лабораторные и инструментальные исследования | |
| Очень часто | Повышение активности «печеночных» ферментов3) |
| Часто | Повышение концентрации тропонина4) |
| Часто | Повышение концентрации тропонина Т |
| Часто | Снижение количества тромбоцитов |
1 HP, связанные с терапией, которые отмечены вне клинических исследований, в том числе в пострегистрационном периоде.
2 Гепатотоксичность включает стеатогепатоз и патологическое повышение активности трансаминаз.
3 Увеличение активности «печеночных» ферментов включает: повышение активности АЛТ, повышение содержания аммиака, повышение активности ACT, повышение активности гаммаглутамилтрансферазы, повышение активности «печеночных» ферментов, повышение показателей «печеночных» тестов и повышение активности трансаминаз.
4 Повышение концентрации тропонина включает повышение концентрации тропонина и повышение концентрации тропонина I.
Описание отдельных нежелательных реакций
Нарушения со стороны печени и желчевыводящих путей
В клинических исследованиях у 31% пациентов, получивших препарат в рекомендуемой дозе, отмечено повышение активности трансаминаз >2×ВГН (в ряде случаев >20 ВГН). У таких пациентов отсутствовали какие-либо клинические проявления, ни у одного не отмечено клинически значимого повышения концентрации билирубина. Как правило, на фоне применения преднизолона повышение активности трансаминаз разрешалось без клинических последствий (см. разделы «Способ применения и дозы» и «Особые указания»). Вне клинических исследований, в том числе при применении в пострегистрационном периоде, зарегистрированы случаи развития признаков и симптомов острой печеночной недостаточности (например, желтуха, коагулопатия, энцефалопатия) в течение 2 месяцев после применения препарата, несмотря на применение глюкокортикостероидов до и после инфузии. Согласно полученной информации, в случаях развития острой печеночной недостаточности проводили коррекцию режима дозирования глюкокортикостероидов с последующим разрешением состояния.
Преходящая тромбоцитопения
В клинических исследованиях после инфузии препарата зарегистрировано неоднократное преходящее снижение среднего количества тромбоцитов относительно исходного уровня (4,0%); как правило, этот показатель восстанавливался в течение двух недель. Снижение количества тромбоцитов было более выраженным в течение первой недели после инфузии.
Повышение концентрации тропонина 1
После инфузии препарата Золгенсма отмечалось повышение уровня тропонина I (3,0%) до 0,2 мкг/л. В программе клинических исследований у пациентов, получивших лечение онасемноген абепарвовеком, клинически значимых нарушений со стороны сердца не наблюдалось (см. раздел «Особые указания»).
Иммуногенность
Титр антител к AAV9 в ходе клинических исследований оценивали как в пре-, так и в постинфузионном периоде (см. раздел «Особые указания»). В клинических исследованиях препарата Золгенсма все пациенты до лечения имели титр антител к AAV9 на уровне 1:50 или ниже. Среднее увеличение титра антител к AAV9 относительно исходного уровня наблюдалось у всех пациентов в различных временных точках, кроме одной, что отражает нормальный ответ организма на чужеродный вирусный антиген. У некоторых пациентов титр антител к AAV9 был выше предела количественного определения, однако у большинства таких пациентов не отмечалось развития потенциально клинически значимых HP. Таким образом, какой-либо взаимосвязи между высоким титром антител к AAY9 и вероятностью развития HP или показателями эффективности установлено не было.
В клиническом исследовании AVXS-101-CL-101 у 16 пациентов был проведен скрининговый тест на титр антител к AAV9: у 13 пациентов титр был ниже 1:50, и они были включены в исследование; у трех пациентов титр был выше 1:50, у двух из них при повторном анализе, проведенном после прекращения грудного вскармливания, титр был ниже 1:50, и они также были включены в исследование. Информация о необходимости отказа от грудного вскармливания матерям с возможной серопозитивностью к AAV9 антителам отсутствует. До введения препарата Золгенсма титр антител к AAV9 у всех пациентов был ниже 1:50; при этом впоследствии у них было выявлено увеличение титра антител к AAV9 от минимум 1:102 400 до более чем 1:819 200.
Обнаружение антител в значительной степени зависит от чувствительности и специфичности анализа. Кроме того, частота обнаружения антител (в том числе нейтрализующих) может зависеть от целого ряда факторов, в том числе: метод анализа, процедура обработки образца, момент времени взятия образца, применение иных лекарственных препаратов и основного заболевания.
Ни у одного из пациентов, получивших препарат Золгенсма, иммунного ответа на трансген выявлено не было.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Данных по передозировке препарата Золгенсма в клинических исследованиях получено не было. В случае системного иммунного ответа рекомендуется скорректировать дозу преднизолона и тщательно наблюдать за лабораторными показателями (включая биохимические и гематологические показатели) и клиническим состоянием пациента (см. раздел «Особые указания»).
Взаимодействие с другими лекарственными препаратами
Исследования по изучению взаимодействия с другими лекарственными препаратами не проводились. Препарат Золгенсма нельзя смешивать с другими лекарственными препаратами.
Опыт применения препарата у пациентов, получающих гепатотоксичные препараты или использующих гепатотоксичные вещества, ограничен. Безопасность применения онасемноген абепарвовека у данной категории пациентов не установлена.
Опыт применения препарата в сочетании с другими препаратами для лечения СМА ограничен.
Вакцинация
По возможности график вакцинации пациента следует скорректировать с учетом введения глюкокортикостероида до и после инфузии препарата Золгенсма (см. раздел «Способ применения и дозы» и «Особые указания»). Рекомендуется проведение сезонной вакцинации против респираторно-синцитиального вируса. Пациентам, получающим глюкокортикостероиды в иммуносупрессивных дозах (например, преднизолон в дозе 20 мг или 2 мг/кг массы тела либо другой глюкокортикостероид в эквивалентной дозе ежедневно на протяжении ≥2 недель), не следует вводить живые вакцины, такие как тривакцина против кори, эпидемического паротита и краснухи и вакцина против ветряной оспы.
Особые указания
Предсуществующий иммунитет к ААV9
Образование анти-ААУ9 антител может наблюдаться на фоне естественного воздействия вируса. В ряде исследований, направленных на изучение распространенности антител к AAV9 в общей популяции, установлена низкая частота предшествующего контакта с AAV9 вирусом в педиатрической популяции. Следует оценить содержание антител к AAV9 у пациентов до инфузии препарата Золгенсма. Повторное тестирование может быть выполнено, если титр антител к AAV9 превышает 1:50. Эффективность и безопасность применения препарата Золгенсма у пациентов с уровнем анти-ААУ9 антител выше 1:50 неизвестна (см. раздел «Способ применения и дозы»).
Спинальная мышечная атрофия в поздней стадии
Поскольку СМА вызывает прогрессирующее и необратимое повреждение моторных нейронов, польза применения препарата Золгенсма у симптоматических пациентов зависит от степени тяжести заболевания на момент лечения, при этом раннее начало терапии имеет потенциально более высокую эффективность.
Несмотря на то, что у пациентов со СМА на поздних стадиях развитие крупной моторики не достигнет уровня здоровых сверстников, такие пациенты могут получить клиническую пользу от заместительной генной терапии, эффективность которой зависит от степени развития заболевания на момент лечения. Лечащий врач должен учитывать, что польза от терапии значительно снижается у пациентов с выраженной мышечной слабостью и дыхательной недостаточностью, у пациентов, находящихся на постоянной искусственной вентиляции легких (ИВЛ), и у пациентов, не способных глотать.
У пациентов со СМА на поздней стадии, которым требуется жизнеобеспечение с постоянной ИВЛ, без способности полноценно развиваться, соотношение польза/риск препарата не установлено.
Иммуногенности
Иммунный ответ к капсиду AAV9 произойдет после инфузии онасемноген абепарвовека, включая образование антител против капсида AAV9, несмотря на иммуномодулирующую терапию, описанную в разделе «Способ применения и дозы», и опосредованный Т-клетками иммунный ответ.
При применении препарата Золгенсма отмечались случаи системного иммунного ответа, в том числе иммуноопосредованной гепатотоксичности, в основном проявлявшейся увеличением активности АЛТ и ACT, а в некоторых случаях – в виде острого тяжелого поражения печени или острой печеночной недостаточности. Иммуноопосредованная гепатотоксичность может требовать коррекции схемы применения глюкокортикостероидов, в том числе более длительного применения, увеличения дозы или более длительного периода постепенной отмены (см. раздел «Способ применения и дозы» и подразделы ниже «Гепатотоксичность» и «Иммуномодулирующая терапия»).
Гепатотоксичность
- Введение AAV-вектора может приводить к повышению активности трансаминаз, что может вызывать серьезные последствия.
- Отмечались случаи острого тяжелого поражения печени и острой печеночной недостаточности (см. раздел «Побочное действие»).
- У пациентов с сопутствующим нарушением функции печени или острым вирусным инфекционным заболеванием печени может увеличиваться риск острого тяжелого поражения печени / острой печеночной недостаточности (см. раздел «Способ применения и дозы»).
- У всех пациентов перед проведением инфузии необходимо провести клиническое и лабораторное обследование для оценки функции печени (определение активности ACT, АЛТ и концентрации общего билирубина (см. раздел «Способ применения и дозы»)).
- С целью сокращения возможного риска повышения активности трансаминаз у всех пациентов рекомендовано проведение коррекции глюкокортикостероидами до и после введения препарата Золгенсма (см. раздел «Способ применения и дозы»).
- Следует контролировать функцию печени в течение по меньшей мере 3 месяцев после инфузии (см. раздел «Способ применения и дозы»).
- Риски и пользу, связанные с применением препарата Золгенсма у пациентов с нарушением функции печени, следует тщательно сопоставлять с рисками, которым подвергается пациент в отсутствие терапии.
Активность ACT и АЛТ и концентрацию общего билирубина следует контролировать еженедельно в течение 30 дней после инфузии препарата Золгенсма, и далее каждые две недели в течение последующих 60 дней или более вплоть до окончания периода постепенного снижения дозы глюкокортикостероида. Постепенную отмену преднизолона не следует рассматривать до снижения активности АСТ/АЛТ ниже уровня 2×ВГН.
Тромбоцитопения
В клинических исследованиях препарата Золгенсма отмечались случаи транзиторного снижения количества тромбоцитов, некоторые из которых удовлетворяли критериям тромбоцитопении (см. раздел «Побочное действие»). В большинстве случаев минимальное количество тромбоцитов отмечалось в первую неделю после инфузии препарата. Количество тромбоцитов следует определять до инфузии препарата Золгенсма и далее регулярно контролировать: еженедельно в течение первого месяца и один раз в две недели в течение второго и третьего месяцев вплоть до возвращения количества тромбоцитов к исходному.
Тромботическая микроангиопатия
В пострегистрационном периоде отмечены случаи тромботической микроангиопатии (ТМА). ТМА характеризуется тромбоцитопенией, микроангиопатической гемолитической анемией. Также наблюдалось острое поражением почек. Возникновение случаев ТМА регистрировали в течение недели после применения препарата Золгенсма. В некоторых случаях одновременная активация иммунной системы (например, в результате инфекции, вакцинации) признана способствующим фактором.
Тромбоцитопения является ключевым признаком ТМА, в связи с чем необходимо контролировать количество тромбоцитов (см. подраздел «Тромбоцитопения»), наряду с другими признаками и симптомами, такими как артериальная гипертензия, образование кожных и подкожных кровоизлияний, судороги или уменьшение количества выделяемой мочи. В случае, если данные признаки и симптомы возникают на фоне тромбоцитопении, следует провести дальнейшую диагностическую оценку с целью выявления гемолитической анемии и нарушения функции почек.
При выявлении клинических признаков, симптомов и/или лабораторных показателей ТМА следует незамедлительно проконсультировать пациента у детского гематолога и/или детского нефролога с целью подбора терапии ТМА согласно клиническим показаниям.
Тропонин I
После инфузии препарата Золгенсма отмечались случаи повышения концентрации сердечного тропонина I (см. раздел «Побочное действие»). У некоторых пациентов увеличение концентрации тропонина I может указывать на повреждение ткани миокарда. На основании этих результатов и кардиотоксичности, отмеченной в доклинических исследованиях у мышей, концентрацию тропонина I следует определять до инфузии препарата Золгенсма и контролировать в течение по меньшей мере последующих 3 месяцев вплоть до возвращения данного показателя в пределы нормы для пациентов со СМА. При необходимости следует рассмотреть вопрос о консультации у специалиста-кардиолога.
Иммуномодулирующая терапия
Не следует начинать иммуномодулирующую терапию на фоне активной инфекции, как острой (например, острая респираторная инфекция или острый гепатит), так и неконтролируемой хронической инфекции (например, хронический гепатит В в активной фазе) (см. раздел «Способ применения и дозы» и «Особые указания»).
Иммуномодулирующий режим (см. раздел «Способ применения и дозы») также может оказывать влияние на иммунный ответ к сопутствующим инфекциям (например, респираторным), что может привести к их более тяжелому клиническому течению. Терапию препаратом Золгенсма следует отложить у пациентов с сопутствующим инфекционным заболеванием до его разрешения или до достижения контроля над инфекцией. Рекомендовано уделять особое внимание диагностике и активной терапии инфекционных заболеваний соответственно. Рекомендовано проведение своевременной сезонной профилактики респираторно-синцитиальных вирусных инфекций. По возможности график вакцинации пациента следует скорректировать с учетом применения глюкокортикостероидов в пре- и постинфузионном периоде применения препарата Золгенсма (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Лечащему врачу следует помнить о возможном развитии надпочечниковой недостаточности в случае продолжительного применения глюкокортикостероида или при увеличении его дозы.
Выделение онасемноген абепарвовека
Временное выделение онасемноген абепарвовека происходит, главным образом, с продуктами жизнедеятельности. Лицам, осуществляющим уход, и семьям пациентов следует рекомендовать следующие инструкции по правильному обращению с испражнениями пациента:
- В течение как минимум одного месяца после введения препарата следует тщательно соблюдать гигиену рук после непосредственного контакта с продуктами жизнедеятельности пациента.
- Одноразовые подгузники можно плотно упаковывать в двойные пластиковые пакеты и утилизировать вместе с бытовыми отходами.
Содержание натрия
Препарат содержит 4,6 мг натрия на 1 мл, что эквивалентно 0,23% от рекомендуемого ВОЗ максимального суточного потребления натрия (=2 г) для взрослого человека. Каждый флакон объемом 5,5 мл содержит 25,3 мг натрия, каждый флакон объемом 8,3 мл содержит 38,2 мг натрия.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Золгенсма не влияет или оказывает незначительное влияние на способность управлять транспортными средствами и работу с механизмами.
Форма выпуска
По 5,5 или 8,3 мл раствора для инфузий в стерильный, бесцветный пластиковый флакон Crystal Zenith из циклоолефинового полимера объемом 10 мл, укупоренный серой резиновой пробкой из хлорбутила, обкатанной алюминиевым колпачком с пластиковой отщелкивающейся крышкой («flip-off» устройство) светло-зеленого цвета. На горлышке флакона расположен стикер с описанием маркировки флакона на русском языке.
Набор из 2-14 флаконов по 5,5 мл и/или 8,3 мл в картонную подложку для флаконов вместе с инструкцией по медицинскому применению в пачку картонную, на которую нанесен стикер.
Варианты конфигурации наборов:
| Флакон объемом 5,5 мл | Флакон объемом 8,3 мл |
| 0 | 2 |
| 2 | 1 |
| 1 | 2 |
| 0 | 3 |
| 2 | 2 |
| 1 | 3 |
| 0 | 4 |
| 2 | 3 |
| 1 | 4 |
| 0 | 5 |
| 2 | 4 |
| 1 | 5 |
| 0 | 6 |
| 2 | 5 |
| 1 | 6 |
| 0 | 7 |
| 2 | 6 |
| 1 | 7 |
| 0 | 8 |
| 2 | 7 |
| 1 | 8 |
| 0 | 9 |
| 2 | 8 |
| 1 | 9 |
| 0 | 10 |
| 2 | 9 |
| 1 | 10 |
| 0 | 11 |
| 2 | 10 |
| 1 | 11 |
| 0 | 12 |
| 2 | 11 |
| 1 | 12 |
| 0 | 13 |
| 2 | 12 |
| 1 | 13 |
| 0 | 14 |
Допускается наличие контроля первичного вскрытия.
Условия хранения
При температуре не выше минус 60 °С.
Хранить в оригинальной картонной упаковке до момента использования.
После получения хранить в холодильнике при температуре 2 °С — 8 °С.
Не замораживать повторно.
Условия транспортирования
При температуре не выше минус 60 °С.
Транспортировка осуществляется с использованием сухого льда SAVSU Evo или сухого льда с пассивной изоляцией (PIDIS) с системой GPS и термодатчиком (TMD) (предоставляется поставщиком транспортных услуг).
Сухой лед SAVSU Evo и PIDIS поддерживают целостность продукта и температуру не выше минус 60 °С.
Срок годности
1 год.
После получения использовать в течение 14 дней.
Подготовленный к инфузии шприц с необходимым объемом препарата использовать в течение 8 часов.
Не применять препарат по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель (все стадии производства)
Новартис Генные Терапии, Инк., США, 1940 ЮЭСДжи Драйв, г. Либертивилл, штат Иллинойс (IL) 60048, США / Novartis Gene Therapies, Inc., 1940 USG Drive, Libertyville, Illinois 60048, USA
Держатель регистрационного удостоверения
Новартис Фарма АГ, Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland
Организация, принимающая претензии потребителей
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 70
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Форма выпуска, упаковка и состав
препарата Золгенсма®
Раствор для инфузий от прозрачного до слегка опалесцирующего, от бесцветного до слегка белого цвета.
Вспомогательные вещества: трометамин, магния хлорид, натрия хлорид, полоксамер 188, хлористоводородная кислота, вода д/и.
Наборы.
5.5 мл и/или 8.3 мл — флаконы пластиковые (2*-14*) со стикером с описанием маркировки — подложки картонные (1) — пачки картонные×.
* Варианты конфигурации наборов (2-14 флаконов в пачке):
× допускается наличие контроля первичного вскрытия (стикер).
Фармакологическое действие
Генотерапевтическое средство, предназначенное для введения функциональной копии гена выживания моторных нейронов 1 (SMN1) в трансдуцированные клетки для устранения моногенной первопричины спинальной мышечной атрофии (СМА). Ожидается, что благодаря внедрению в моторные нейроны альтернативного источника экспрессии белка SMN, данное средство обеспечит выживание и корректное функционирование трансдуцированных моторных нейронов.
Онасемноген абепарвовек представляет собой не реплицирующийся рекомбинантный аденоассоциированный вирусный (AAV) вектор, который использует капсид аденоассоциированного вируса серотипа 9 (AAV9) для доставки стабильного, полностью функционального трансгена человеческого SMN. Установлено, что капсид AAV9 способен проникать через ГЭБ и трансдуцировать моторные нейроны. Ген SMN1, содержащийся в онасемноген абепарвовеке, предназначен для того, чтобы персистировать в ядре трансдуцированных клеток в виде эписомальной ДНК, ожидается, что он будет стабильно экспрессироваться на протяжении длительного времени в постмитотических клетках. Способность вируса AAV9 вызывать заболевание у человека неизвестна. Трансген вводится в клетки-мишени в виде самокомплементарной двухцепочечной молекулы. Экспрессия трансгена регулируется конститутивным промотором (гибрид промотора гена куриного β-актина и энхансера транскрипции цитомегаловируса), который обеспечивает постоянную и устойчивую экспрессию белка SMN. Описанный механизм действия подкреплен данными доклинических исследований и данными по биораспределению в организме человека.
Фармакокинетика
Оценка биораспределения была проведена у двух пациентов, которые умерли через 5.7 и 1.7 месяцев соответственно после инфузии препарата онасемноген абепарвовека в дозе 1.1×1014 вектор-геномов (вг)/кг. В обоих случаях максимальное содержание векторной ДНК было обнаружено в печени. Векторная ДНК была также обнаружена в селезенке, сердце, поджелудочной железе, паховых лимфатических узлах, скелетных мышцах, периферических нейронах, почках, легких, кишечнике, гонадах, спинном мозге, головном мозге и тимусе. Иммунное окрашивание на белок SMN выявило генерализованную экспрессию SMN в моторных нейронах спинного мозга, нейронах и глиальных клетках головного мозга, а также в сердце, печени, скелетных мышцах и других изученных тканях. Исследования выделения вектора онасемноген абепарвовека оценивали количество вектора, выводимого из организма со слюной, мочой и калом. Онасемноген абепарвовек обнаруживался в биологическом материале в постинфузионном периоде. Онасемноген абепарвовек выводился главным образом с калом, причем основная часть выводилась в течение 30 сут после применения.
Показания активных веществ препарата
Золгенсма®
Спинальная мышечная атрофия (СМА) с биаллельной мутацией в гене SMN1 и клиническим диагнозом СМА 1 типа; СМА с биаллельной мутацией гена SMN1 и не более чем с тремя копиями гена SMN2.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Предназначен только для однократной в/в инфузии. Номинальная доза онасемноген абепарвовек составляет 1.1×1014 вг/кг. Общий вводимый объем определяется массой тела пациента.
Применяется в комплексе с иммуномодулирующей терапией по специальной схеме.
Лечение следует начинать и проводить в клинических центрах под наблюдением врача, имеющего опыт ведения пациентов со СМА.
Перед применением данного средства необходимо провести следующие лабораторные исследования: тест на определение содержания антител к AAV9 с использованием соответствующего валидированного метода исследования; оценка функции печени — определение активности АЛТ, АСТ и концентрации общего билирубина; клинический анализ крови (включая концентрацию гемоглобина и количество тромбоцитов); тест на тропонин I; определение концентрации креатинина.
Необходимость тщательного мониторинга функции печени, количества тромбоцитов и концентрации тропонина I после инфузии, а также необходимость назначения терапии ГКС следует учитывать при определении сроков лечения онасемноген абепарвовеком.
В случае острых или хронических неконтролируемых активных инфекций лечение следует отложить до разрешения инфекции или окончания фазы обострения.
Побочное действие
Со стороны крови и лимфатической системы: часто — тромбоцитопения; неизвестно — тромботическая микроангиопатия (ТМА).
Со стороны пищеварительной системы: часто — рвота.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности печеночных ферментов; часто — гепатотоксичность; неизвестно — острая печеночная недостаточность, острое поражение печени.
Общие реакции: часто — пирексия.
Лабораторные исследования: часто — повышение концентрации тропонина (включает повышение концентрации тропонина и повышение концентрации тропонина I), повышение концентрации тропонина Т.
Противопоказания к применению
Повышенная чувствительность к онасемноген абепарвовеку.
С осторожностью
Нарушения функции почек, нарушения функции печени (в частности, у пациентов с повышенной концентрацией билирубина, не связанной с желтухой новорожденных), недоношенные новорожденные до достижения ими возраста, соответствующего гестационному возрасту доношенного ребенка.
Применение при беременности и кормлении грудью
Исследования репродуктивной и эмбриофетальной токсичности данного средства у животных не проводились.
Применение при нарушениях функции печени
Необходима осторожность при рассмотрении вопроса о применении данного средства у пациентов с нарушением функции печени. Коррекция дозы не требуется.
Применение при нарушениях функции почек
Необходима осторожность при рассмотрении вопроса о применении данного средства у пациентов с нарушением функции почек. Коррекция дозы не требуется.
Применение у детей
Предназначен для применения у детей по показаниям.
Безопасность и эффективность онасемноген абепарвовека у недоношенных новорожденных до достижения полного гестационного возраста не установлены. Данные по применению препарата у данной категории пациентов отсутствуют. Следует тщательно оценить возможность применения препарата в связи с возможным негативным влиянием глюкокортикостероидов на их неврологическое развитие
Опыт применения препарата у пациентов 2 лет и старше или с массой тела выше 13,5 кг ограничен. Безопасность и эффективность онасемноген абепарвовека у данной группы пациентов не установлены
Применение у пожилых пациентов
Не применимо.
Особые указания
Образование анти-AAV9 антител может наблюдаться на фоне естественного воздействия вируса. В ряде исследований, направленных на изучение распространенности антител к AAV9 в общей популяции, установлена низкая частота предшествующего контакта с AAV9 вирусом в педиатрической популяции. Следует оценить содержание антител к AAV9 у пациентов до инфузии данного средства. Повторное тестирование может быть выполнено, если титр антител к AAV9 превышает 1:50. Эффективность и безопасность применения данного средства у пациентов с уровнем анти-AAV9 антител выше 1:50 неизвестна.
Поскольку СМА вызывает прогрессирующее и необратимое повреждение моторных нейронов, терапевтическая эффективность применения данного средства у пациентов с клиническими симптомами зависит от степени тяжести заболевания на момент лечения, при этом раннее начало терапии имеет потенциально более высокую эффективность. Несмотря на то, что у пациентов со СМА на поздних стадиях развитие крупной моторики не достигнет уровня здоровых сверстников, такие пациенты могут получить клиническую пользу от заместительной генной терапии, эффективность которой зависит от степени развития заболевания на момент лечения. Лечащий врач должен учитывать, что польза от терапии значительно снижается у пациентов с выраженной мышечной слабостью и дыхательной недостаточностью, у пациентов, находящихся на ИВЛ и у пациентов, не способных глотать.
У пациентов со СМА на поздней стадии, которым требуется жизнеобеспечение с постоянной ИВЛ, без способности полноценно развиваться, соотношение польза/риск препарата не установлено.
Иммунный ответ к капсиду AAV9 произойдет после инфузии онасемноген абепарвовека, включая образование антител против капсида AAV9, несмотря на иммуномодулирующую терапию и опосредованный Т-клетками иммунный ответ.
При применении данного средства отмечались случаи системного иммунного ответа, в т.ч. иммуноопосредованной гепатотоксичности, в основном проявлявшейся увеличением активности АЛТ и АСТ, а в некоторых случаях — в виде острого тяжелого поражения печени или острой печеночной недостаточности. Иммуноопосредованная гепатотоксичность может требовать коррекции схемы применения ГКС, в т.ч. более длительного применения, увеличения дозы или более длительного периода постепенной отмены.
У пациентов с сопутствующим нарушением функции печени или острым вирусным инфекционным заболеванием печени может увеличиваться риск острого тяжелого поражения печени/острой печеночной недостаточности. Следует контролировать функцию печени в течение по меньшей мере 3 месяцев после инфузии.
Риск и пользу, связанные с применением данного средства у пациентов с нарушением функции печени, следует тщательно сопоставлять с рисками, которым подвергается пациент в отсутствие терапии.
В некоторых случаях одновременная активация иммунной системы (например, в результате инфекции, вакцинации) признана способствующим фактором развития тромботической микроангиопатии.
Тромбоцитопения является ключевым признаком тромбоцитопенической микроангиопатии, в связи с чем необходимо контролировать количество тромбоцитов, наряду с другими признаками и симптомами, такими как артериальная гипертензия, образование кожных и подкожных кровоизлияний, судороги или уменьшение количества выделяемой мочи. В случае, если данные признаки и симптомы возникают на фоне тромбоцитопении, следует провести дальнейшую диагностическую оценку с целью выявления гемолитической анемии и нарушения функции почек. При выявлении клинических признаков, симптомов и/или лабораторных показателей ТМА следует незамедлительно проконсультировать пациента у детского гематолога и/или детского нефролога с целью подбора терапии ТМА согласно клиническим показаниям.
В некоторых случаях увеличение концентрации тропонина I может указывать на повреждение ткани миокарда. На основании этих результатов и кардиотоксичности, отмеченной в доклинических исследованиях у мышей, концентрацию тропонина I следует определять до инфузии данного средства и контролировать в течение по меньшей мере последующих 3 месяцев вплоть до возвращения данного показателя в пределы нормы для пациентов со СМА. При необходимости следует рассмотреть вопрос о консультации у специалиста-кардиолога.
Не следует начинать иммуномодулирующую терапию на фоне активной инфекции, как острой (например, острая респираторная инфекция или острый гепатит), так и неконтролируемой хронической инфекции (например, хронический гепатит B в активной фазе).
Иммуномодулирующий режим также может оказывать влияние на иммунный ответ к сопутствующим инфекциям (например, респираторным), что может привести к их более тяжелому клиническому течению. Рекомендовано уделять особое внимание диагностике и активной терапии инфекционных заболеваний соответственно. Рекомендовано проведение своевременной сезонной профилактики респираторно-синцитиальных вирусных инфекций.
По возможности график вакцинации пациента следует скорректировать с учетом применения ГКС в пре- и постинфузионном периоде применения данного средства. Лечащему врачу следует помнить о возможном развитии надпочечниковой недостаточности в случае продолжительного применения ГКС или при увеличении его дозы.
Временное выделение онасемноген абепарвовека происходит, главным образом, с продуктами жизнедеятельности. Лицам, осуществляющим уход, и семьям пациентов следует рекомендовать следующие инструкции по правильному обращению с испражнениями пациента: в течение как минимум одного месяца после введения препарата следует тщательно соблюдать гигиену рук после непосредственного контакта с продуктами жизнедеятельности пациента; одноразовые подгузники можно плотно упаковывать в двойные пластиковые пакеты и утилизировать вместе с бытовыми отходами.
Лекарственное взаимодействие
По возможности график вакцинации пациента следует скорректировать с учетом введения ГКС до и после инфузии данного средства. Рекомендуется проведение сезонной вакцинации против респираторно-синцитиального вируса.
Пациентам, получающим ГКС в иммуносупрессивных дозах (например, преднизолон в дозе 20 мг или 2 мг/кг массы тела либо другой ГКС в эквивалентной дозе ежедневно на протяжении >2 недель), не следует вводить живые вакцины, такие как тривакцина против кори, эпидемического паротита и краснухи и вакцина против ветряной оспы.
Чем лечится спинальная мышечная атрофия
СМА делят на четыре типа, первые три диагностируют у детей младше 6 месяцев, между 7 и 18 месяцами и после 18 месяцев; четвертый тип поражает взрослых и обычно вызывает только легкие проблемы. В прошлом дети с заболеванием 1 типа редко проживали дольше первых нескольких лет. Но в последние годы, благодаря ранней диагностике и лечению, результаты улучшились. Большинство детей с типом 2 доживают до взрослого возраста и могут жить долго и полноценно. Типы 3 и 4, как правило, не влияют на продолжительность жизни. Заболеваемость СМА составляет приблизительно 1 на 11 000 живорожденных, причем доминирует СМА типа 1. В США насчитывается 10–25 тыс. больных СМА, в странах ЕС — 21–25 тыс., в России — предположительно, 2–3 тыс.
Если исключить неэффективную поддерживающую терапию, то для лечения спинальной мышечной атрофии есть лишь три препарата.
«Спинраза» (нунинерсен) — первое лекарство, одобренное FDA для применения детьми и взрослыми в 2016 году. Разработчиком является американская интернациональная биотехнологическая компания Biogen Inc. «Спинраза» с 2017 года также разрешена к применению в ЕС; в России — с 2019 года (ЛП-005730-160819). Активный компонент «Спинразы» представляет собой антисмысловой олигонуклеотид, действующий на гены выживаемости двигательных нейронов (SMN2, от Survival Motor Neuron), который вводят в спинномозговую жидкость инъекционно. За первым введением должны последовать еще три инъекции — через 2, 4 и 9 недель, а затем по дозе раз в 4 месяца. Терапию продолжают до тех пор, пока пациент получает от нее пользу. Цена «Спинразы» в США составляет 133 тыс. долларов за одну инъекцию, а стоимость лечения — 750 тыс. долларов за первый год терапии и по 375 тыс. долларов ежегодно в последующие годы.
«Эврисди» (рисдиплам) — первый пероральный препарат для лечения СМА, одобренный FDA августе 2020 года для лечения пациентов старше двух месяцев. В тот же год зарегистрирован в РФ (ЛП-006602-261120). Это разработка американской биотехнологической корпорации Genentech, Inc., входящей в состав F. Hoffmann-La Roche AG. «Эврисди», в отличие от «Спинразы», — это малая гетероциклическая молекула, которая выступает модификатором сплайсинга РНК, направленного на выживание SMN2. Препарат используют ежедневно и пожизненно. Годовая стоимость начинается с менее 100 тыс. долларов, а предельная достигает 340 тыс. долларов, в зависимости от массы тела пациента.
«Золгенсма» (онасемноген абепарвовек) — препарат, который производится базирующейся в США швейцарской биофармацевтической компанией Novartis Gene Therapies. Впервые одобрен FDA 24 мая 2019 года, в РФ — до сих пор не зарегистрирован. Это наиболее эффективный препарат для лечения СМА, основанный на генно-терапевтическом подходе. «Золгенсма» несет рабочий ген SMN1, находящийся внутри аденоассоциированного вируса, который выступает как вектор. Активный ингредиент проникает в нервы и восстанавливает ген, который затем производит белки, необходимые для функционирования нервов и контроля движения мышц. Доза определяется в зависимости от веса пациента. То есть «Золгенсма» заменяет отсутствующий или нерабочий ген SMN1 на функциональную копию, нормализуя выработку белка выживаемости мотонейронов.
Таким образом, болезнь можно излечить и обратить вспять патологические изменения, сделав всего одну внутривенную инфузию. «Золгенсма» — самое дорогое лекарство в мире, цена составляет 2,125 млн долларов. Эту сумму помогал собирать Моргенштерн.
Ценообразование и Big Pharma
Выяснить причину непомерной стоимости попыталось интернет-издание FactChecker, основываясь на общении с врачами и заявлениях представителей компании Novartis. В первую очередь главной проблемой называют мизерный размер потенциального рынка. СМА встречается редко, поэтому необходим узкоспециализированный препарат — чем меньше случаев заболевания, тем выше будет его цена. Кроме того, «Золгенсма» вводится однократно.
«Оптовая стоимость приобретения (WAC) препарата „Золгенсма“ составляет 2,125 млн долларов — менее 50% от десятилетней стоимости текущей стандартной терапии хронической СМА в США и находится в пределах пороговых значений экономической эффективности для редких заболеваний, используемых Институтом исследований экономической эффективности. Ожидается, что со временем препарат сэкономит расходы системы здравоохранения на лечение и уход за пациентами со СМА. Мы налаживаем гибкие партнерские отношения с плательщиками, чтобы обеспечить доступность и приемлемую стоимость», — сообщил изданию FactChecker международный представитель компании Novartis.
Также он отметил, что окончательные решения о ценообразовании и возмещении расходов принимаются на местном уровне.
Согласно исследованию, опубликованному в 2016 году в журнале Journal of Health Economics, на создание одного нового лекарства уходит около 2,6 млрд долларов и более 10 лет. Только 14% лекарств, проходящих клинические испытания, в конечном итоге получают одобрение FDA, поскольку значительная часть испытаний не завершается успехом, как показало исследование Массачусетского технологического института (MIT). Исследователи из MIT и Института онкологии Дана — Фарбера предложили финансировать покупку дорогостоящих лекарств с помощью аналога ипотеки, чтобы пациенты могли платить в рассрочку при условии, что препарат работает.
С учетом большой вероятности неудачи компаниям-разработчикам приходится полагаться на малое количество успешных препаратов для того, чтобы компенсировать расходы и иметь возможность вкладываться в новые исследования. Кроме того, выпущенные на рынок лекарства сталкиваются с продукцией конкурентов, что ведет к снижению цены. Особенно мощное влияние оказывают препараты-дженерики, массово появляющиеся после окончания срока действия патента.
Рассчитано, что после появления 5–6 дженериков цены на такие препараты снижались примерно на 95%.
Помимо дженериков, угрозой для компаний-разработчиков выступают государства, игнорирующие международное патентное право на уровне местного законодательства. Например, в России из-за нехватки бюджетных средств на покупку импортных лекарств в 2016 году предложили ввести принудительное лицензирование иностранных препаратов «для лечения социально значимых заболеваний». Суть идеи — выдавать лицензии отечественным фармацевтическим производствам, невзирая на действующий оригинальный патент. В апреле 2021 года президент подписал внесение соответствующих изменений в закон. Первым препаратом, который запустили в производство в обход патента, стал противовирусный «Ремдесивир» (Veklury®, патентодержатель — Gilead Sciences International, Ltd., Великобритания), одобренный для лечения COVID-19 и вошедший в перечень ЖНВЛП. Теперь «Ремдесивир» производит группа компаний «Фармасинтез». Такую практику давно применяют в Бразилии, Китае и Индии. Прецеденты известны в Германии («Полиферон»), США (давление на компанию Bayer, чтобы снизить цену на препарат от сибирской язвы) и в некоторых других странах. Минусом принудительного лицензирования является «отпугивание» иностранных компаний, которые могут прекратить вывод разработанных новинок на российский рынок.
Кроме того, в РФ компанией BIOCAD разрабатывается отечественный аналог «Золгенсма» — ANB-4, с аналогичным механизмом действия. Однако неизвестно, когда завершатся испытания препарата, пройдут ли они успешно и сколько будет стоить новое лекарство для конечного потребителя. По весьма оптимистичным оценкам, ANB-4 может выйти на рынок через 3–5 лет.
Обоснование высокой цены «Золгенсма» в том, что именно такую цену установила компания Novartis, поскольку лекарство «радикально изменяет жизнь пациентов, страдающих от этого разрушительного заболевания, и их семей», а также в заявленной стоимости вывода новых препаратов на рынок. Но это утверждение отчасти противоречиво.
Начальные этапы разработки «Золгенсма» финансировались за счет Национального института здравоохранения, а также рядом благотворительных организаций, ориентированных на поиск новых средств для терапии СМА, включая многие американские благотворительные фонды: Cure SMA, Sophia’s Cure, Fighting SMA, Gwendolyn Strong Foundation, Miracle for Madison и другие. Часть этих фондов собирает пожертвования родственников и близких пациентов, чтобы финансировать разработку и клинические исследования новых лекарственных препаратов.
Главный исполнительный директор компании Novartis Васант Нарасимхан вполне обоснованно считает, что генная терапия является прорывным медицинским подходом, так как она дает возможность лечить смертельные генетические заболевания однократным введением препарата. Однако в ряде случаев подходящей заменой может выступать длительная терапия, вызывающая постепенные улучшения. Альтернативой для «Золгенсма» выступает «Спинраза» — стоимость ее применения составляет 4 млн долларов за десять лет.
В преддверии потенциального одобрения лекарства для других типов СМА и в новых географических регионах компания Novartis в 2018–2020 годах увеличила производственные мощности по выпуску «Золгенсма». Однако производство препарата представляет собой сложный процесс, включающий несколько этапов в восходящем и нисходящем производстве, при этом максимальная продолжительность этапов составляет по несколько дней. Производство состоит из пяти этапов или единичных операций: 1) выращивание эмбриональных клеток почки человека (HEK293); 2) клетки собирают и используют для инокуляции в биореактор; 3) выращенные клетки трансфицируются раствором трех ДНК-плазмид; 4) после культивирования клеток их собирают и осветляют; 5) получают интермедиат, который затем замораживается. Совместная трансфекция клеток HEK293 ведется с применением трех плазмид, которые готовят отдельно: векторная плазмида (pSMN); аденоассоциированная вирусная плазмида (pAAV2/9); плазмида аденовируса-хелпера (pHELP). После размораживания и объединения промежуточного продукта проводят осветление, хроматографическую очистку, фильтрацию, центрифугирование и финальную обработку. На изготовление одной небольшой партии препарата уходит месяц.
Относительно короткий срок годности, не более 12 месяцев, усложняет ситуацию — из-за трудностей производства и хранения практически невозможно создавать запасы лекарства.
Неблагоприятные события прошлого года, связанные с пандемией COVID-19, также вынудили швейцарскую компанию закрыть одно производственное предприятие в конце марта 2021 года, всего через 14 месяцев после открытия. Несмотря на это, «Золгенсма», даже с ценником в 2,125 млн и просевшим из-за COVID-19 спросом, показала достойные результаты в 2020 году, едва не получив статус лекарства-блокбастера, — продажи достигли 920 млн.
Очевидно, что «Золгенсма» не может быть дешевой. Но как Novartis определяет фактическую отпускную цену? Различные компании для ценообразования применяют модели, где рассчитывается стоимость исходя из количества прожитых пациентом лет и с учетом эффективности лекарства. Следовательно, необходимо определить стоимость человеческой жизни, заложив определенную маржу на инвестиции компании. О действительной стоимости вывода на рынок нового лекарства мало что известно. Однако компания Novartis не с нуля разрабатывала препарат «Золгенсма» самостоятельно — его приобрели в процессе покупки AveXis, американской компании, создавшей лекарство-кандидат AVXS-101, названное позже «Золгенсма». Сумма сделки, проведенной в 2018 году, составила 8,7 млрд долларов.
Большинство систем медицинского страхования не поддерживают лечение по такой цене, а огромная стоимость также не служит гарантией того, что препарат оправдает все ожидания. С другой стороны, как отмечено выше, Novartis проявляет некоторую гибкость и разрешает выплачивать деньги в течение пяти лет по 425 тыс. долларов в год, а также планирует частично возвращать деньги, если лечение не сработает. Семьям пациентов следует иметь в виду возможность оплаты препарата в рассрочку.
Кошелек или жизнь
168 млн рублей — много это или мало? Для сравнения, на эту сумму можно построить детский сад на 168 мест (место для одного ребенка стоит примерно 1 млн рублей). А сколько стоит жизнь человека? Во многих цивилизованных странах прокламируется, что человеческая жизнь бесценна. Но по факту это не так. Стоимость жизни — экономическая величина, которую используют для количественной оценки выгоды от предотвращения смертельного исхода. В области общественных наук это предельная стоимость предотвращения смерти при определенных обстоятельствах. Часто она включает также качество жизни, ожидаемое время оставшейся жизни и потенциальный заработок. Последнее используется для страховых выплат или компенсаций после гибели человека. Поэтому в разных странах стоимость жизни значительно отличается. Например, в США она составляет примерно 9,6 млн долларов, в Германии — 1,65 млн евро (~2 млн долларов), в Индии — 0,64 млн долларов. Что касается России, по состоянию на 2020 год, стоимость статистической жизни определяют как 4,7 млн рублей (75,9 тыс. долларов по курсу 2019 года). По другой, более оптимистичной, модели — 15,7 млн для женщин и 18,2 млн для мужчин (218 и 253 тыс. долларов соответственно).
Теперь помещаем на одну чашу весов лекарство за 2,1 млн, а на другую — десятки тысяч… Вопрос, почему даже зарегистрированные дорогостоящие лекарственные препараты неохотно предоставляются госучреждениями, отпадает сам собой. Возможно, одним из вариантов частичного решения этой проблемы могло бы стать добровольное страхование новорожденного ребенка в тех случаях, когда родители имеют генетические аномалии. Также не помешает более тщательный выбор партнеров — с предварительным скринингом на наследственные заболевания до планируемого зачатия вместо игры в орлянку с генетикой.
Статья на конкурс «био/мол/текст»: Не так давно, в мае 2019 года, произошло знаковое событие в сфере лечения генетических заболеваний: Управление по санитарному надзору за качеством продуктов и медикаментов США (FDA) одобрило препарат Zolgensma («Золгенсма», или онасемноген абепарвовек). Это лекарственное средство предназначено для генотерапевтического лечения спинально-мышечной атрофии (СМА). Сегодня «Золгенсма» является самым дорогим лекарственным препаратом в мире.
Что такое СМА?
Спинально-мышечной атрофией, или СМА, называют смертельно опасное нейродегенеративное заболевание, в процессе развития которого у пациента происходит постепенная атрофия скелетной мускулатуры. В результате человек теряет или так и не приобретает способности ходить, самостоятельно стоять, сидеть без поддержки. Со временем возникает сколиоз и другие ортопедические проблемы. Также СМА-пациенты, если они не получают должного ухода и лечения, постепенно утрачивают способность самостоятельно дышать, глотать, кашлять. Пациенты с первым, самым тяжелым, типом СМА еще несколько лет назад, как правило, не доживали и до двух лет [1].
СМА возникает из-за потери участка хромосомы или точечной мутации гена SMN1, расположенного в пятой хромосоме. В результате этого нарушается синтез SMN-белка, недостаток которого приводит к гибели моторных нейронов и атрофии скелетной мускулатуры [2].
Для того чтобы болезнь проявилась, носителем рецессивной мутации в гене SMN1 должны быть оба родителя. Примерно каждый 40-й житель Земли является таким носителем.
Подробнее о причинах возникновения, диагностике, течении спинально-мышечной атрофии читайте в статье «Надежда для СМАйликов» [3].
Терапия спинально-мышечной атрофии до появления «Золгенсмы»
До недавнего времени методы лечения СМА сводились к поддерживающей терапии. Больным рекомендовали специальное питание, витамины, умеренные физические нагрузки, при необходимости — хирургическое вмешательство, искусственная вентиляция легких. К сожалению, до сих пор значительная часть СМА-пациентов получает лишь такое лечение.
Рисунок 1. «Спинраза» — первый препарат, одобренный для лечения СМА
С 2016 года сначала в США, а затем и в Европе для лечения спинально-мышечной атрофии стали применять препарат «Спинраза» (нусинерсен) [4]. Он позволяет существенно увеличить продукцию полноценного SMN-белка, что ведет к сглаживанию симптомов заболевания. Терапия тем эффективнее, чем меньше возраст пациента.
Стоимость препарата составляет несколько сот тысяч долларов в год, поэтому его закупка осуществляется не за счет пациента. Одна за другой страны разных континентов одобрили препарат и стали применять для спасения жизней своих сограждан. В некоторых государствах этот процесс сильно затянулся из-за бюрократических проволочек и нехватки финансирования.
В РФ «Спинразу» Минздрав одобрил в начале 2019. В свою очередь компания «Биоген», производитель «Спинразы», в апреле 2019 г. объявила об открытии в России «Программы расширенного доступа» для лечения СМА нусинерсеном. Благодаря этой программе доступ к препарату получили 40 детей из России, страдающих СМА I типа [5].
В августе «Спинраза» была включена в Государственный реестр лекарственных средств РФ. Однако охват больных все еще слишком мал. В Российской Федерации зарегистрировано около 800 СМА-пациентов, и далеко не все они получают инъекции «Спинразы».
Отличия «Золгенсмы» от «Спинразы»
После появления на фармацевтическом рынке «Спинразы» все ждали выхода принципиально нового препарата для лечения СМА, основанного на генотерапевтическом подходе. Лидером в данной разработке оказалась компания «Новартис» (Novartis), которая в 2018 году купила компанию «Авексис» (AveXis) за 8,7 млрд долларов, а в 2019 вышла на рынок c препаратом «Золгенсма» (Zolgensma, он же AVXS-101, или онасемноген абепарвовек) [6].
Рисунок 2. Логотип препарата «Золгенсма»
Чем же «Золгенсма» принципиально отличается от препарата «Спинраза»? Самое важное различие заключается в механизме действия: «Спинраза» исправляет дефект сплайсинга матричной РНК гена SMN2, но она никак не затрагивает ген SMN1, мутации в котором и являются основной причиной развития спинально-мышечной атрофии.
Действие же препарата «Золгенсма» направлено именно на ген SMN1. Благодаря использованию этого лекарственного средства, мутировавший или отсутствующий ген SMN1 замещается функционально полноценным геном [1].
Происходит это следующим образом: препарат содержит функционально полноценный ген SMN1, который находится внутри вектора. Задача вектора — быстро доставить его в мотонейроны тела (рис. 3).
Рисунок 3. Условное изображение вектора, входящего в состав «Золгенсмы»
Для создания вектора использовали аденоассоциированный вирус (adeno-associative virus 9, или AAV9). Это представитель семейства парвовирусов, который способен инфицировать клетки человека и других приматов, но при этом не является патогенным. Все это делает AAV9 отличным генетическим вектором. Собственный генетический материал вируса удалили и вместо него поместили функционально полноценный ген SMN1 (рис. 4).
Рисунок 4. Условная схема механизма создания вектора
После того, как ген прибывает в нужную локацию, вектор разрушается и выводится из организма.
СМА-пациенту необходима всего одна инфузия препарата «Золгенсма» в течение жизни, в то время как лечение «Спинразой» требует нескольких доз в год. Отсюда и стоимость «Золгенсмы»: 2 125 000 долл. США. Такая ценовая политика компании-производителя делает данный препарат самым дорогим лекарственным средством на сегодняшний день. Для сравнения, стоимость все той же «Спинразы» составляет 125 тыс. долларов за одну дозу. При этом в первый год лечения нужно шесть инфузий, в последующие периоды — три инфузии ежегодно.
Насколько оправдана такая цена препарата и какова же его себестоимость? «Новартис» не афиширует информацию относительно себестоимости «Золгенсмы», поэтому эксперты оценивают стоимость препарата по двум показателям: качество жизни пациента с учетом прожитых лет (QALY) и добавленные годы жизни (LYG). По данным Института клинико-экономической экспертизы (Institute for Clinical and Economic Review, ICER), исходя из показателя QALY стоимость «Золгенсмы» должна быть в пределах 1,1–1,9 миллионов долл. США; исходя из показателя LYG — 1,2–2,1 миллиона долл. США. Таким образом, можно сказать, что стоимость «Золгенсмы» завышена по отношению к оценкам экспертов [7].
При формировании своей ценовой политики компания «Новартис» отталкивалась от стоимости препарата «Спинраза». По задумке производителя в течение десяти лет на лечение СМА-пациента «Спинразой» необходимо будет потратить более 4 млн долларов, в то время как одна инфузия «Золгенсмы» стоит 2 млн 125 тысяч. Таким образом, в долгосрочной перспективе второй вариант более выгоден [8], [9].
Компания «Новартис» ожидала, что «Золгенсма» станет «блокбастером», то есть принесет более 1 млрд долларов за первый год продаж. Однако скандал, который возник вокруг «Золгенсмы», может не дать осуществиться этим планам. Летом 2019 г. компания «Новартис» сама сообщила FDA о манипуляции с данными при проведении тестирования препарата на животных. Если бы эти данные были известны FDA в мае, то разрешение на использование препарата «Золгенсма» «Новартис» получила бы позже, но сейчас принято решение не отзывать препарат [10].
Сумму в два с лишним миллиона долларов не в состоянии заплатить большинство СМА-семей, поэтому предполагается, что пациенты будут обеспечиваться жизненно важным лечением благодаря государственной поддержке или за счет страховых компаний. Кроме того, производитель «Золгенсмы» предоставляет пятилетнюю рассрочку на оплату генной терапии и дает возможность пациенту не выплачивать оставшуюся сумму, если препарат перестанет действовать [8]. Сегодня препарат «Золгенсма» доступен только для жителей США, так как FDA — это единственная организация, которая его одобрила. Также есть ограничения по возрасту и тяжести заболевания: пока препарат применяется только для пациентов до двух лет с первым типом СМА. В дальнейшем производитель планирует использовать препарат и для других групп людей, страдающих спинально-мышечной атрофией.
Важно также отметить, что «Золгенсма» вводится внутривенно. «Спинраза» же должна попасть в спинномозговую жидкость пациента, что создает ряд дополнительных проблем и рисков.
Побочные эффекты «Золгенсмы»
Кроме высокой стоимости, у «Золгенсмы» есть и другие серьезные недостатки. Возможными побочными эффектами препарата являются:
- рвота;
- повышение уровня аминотрансфераз;
- тромбоцитопения;
- нарушение функций печени, вплоть до острого тяжелого поражения.
Не рекомендуется использование «Золгенсмы» у недоношенных детей до достижения ими полного гестационного возраста.
По данным компании-производителя на момент регистрации «Золгенсма» в рамках клинических исследований была применена для терапии 44 детей в возрасте от 0,3 до 7,9 месяцев с массой тела от 3 до 8,4 кг. Такая небольшая выборка объясняется тем, что СМА является редким заболеванием, поэтому набрать большое количество пациентов за короткий период времени — не такая уж и простая задача.
С другой стороны, небольшая выборка означает, что количество побочных эффектов препарата может быть значительно выше, чем известно на данный момент. Так, производитель уведомляет, что один из СМА-пациентов, который участвовал в клинических исследованиях за пределами США, через 12 дней после инфузии препарата начал страдать от дыхательной недостаточности. Также у него были зафиксированы лейкоэнцефалопатия, приступы гипотензии и судорог примерно через месяц после начала лечения. Через 52 дня наступил летальный исход. Но пока сложно сказать, является ли подобное развитие событий реакцией на введение препарата или же эти симптомы появились бы у СМА-пациента и без использования «Золгенсмы».
Важно также отметить, что долгосрочное влияние препарата на организм человека пока неизвестно. Прежде всего, не ясно, будет ли экспрессия гена SMN1 в организме пациента поддерживаться постоянно или постепенно сойдет на нет. Чтобы ответить на этот вопрос, «Новартис» обязана постоянно собирать данные долговременного наблюдения. В разрезе стоимости это является ключевым риском для плательщиков. Компания-производитель пытается снизить эти риски, предлагая рассрочку на пять лет пациентам, с правом приостановить выплаты, если препарат не будет проявлять своего терапевтического действия. Однако если экспрессия гена прекратится после истечения пятилетнего срока, то никакой финансовой компенсации за это не предусмотрено.
Не проводились исследования на животных по оценке онкогенного и мутагенного действий препарата, хотя есть данные о подобных исследованиях для вектора AAV9. Фактически, «Золгенсма» может оказаться как настоящей панацеей для людей, больных СМА, так и генетической бомбой замедленного действия, эффект которой будет заметен только через годы или десятилетия.
Следующий шаг
Компания-производитель «Золгенсмы» планирует в будущем применять препарат для пациентов разных возрастов со СМА II и III типов. Также «Новартис» работает над регистрацией препарата за пределами США.
Рисунок 5. Рисдиплам — препарат для лечения спинально-мышечной атрофии, который находится на стадии клинических испытаний на людях
Появление «Золгенсмы» на фармакологическом рынке повлияло на продажи «Спинразы», поэтому компания «Биоген» уже проводит клинические исследования, направленные на усиление терапевтической активности «Спинразы» путем увеличения ее дозы [11].
Но «Спинраза» и «Золгенсма», возможно, недолго будут единственными препаратами для лечения спинально-мышечной атрофии. Компания «Рош» (Roche) уже достаточно давно ведет клинические испытания своего лекарственного средства (рисдиплама) и, по всей видимости, в ближайшие пару лет данный препарат также выйдет на фармацевтический рынок (рис. 5).
Рисдиплам, как и нусинерсен («Спинраза»), не влияет на ген SMN1, а модифицирует сплайсинг мРНК гена SMN2. Однако у рисдиплама есть существенное отличие: препарат принимается перорально и не требует введения в спинно-мозговую жидкость. Кроме того, рисдиплам подходит для всех типов СМА и в клинических испытаниях показывает более высокую эффективность, чем нусинерсен [12].
По прогнозам экспертов, цена препарата будет значительно ниже, чем «Спинразы» и «Золгенсмы», поэтому новое средство сможет составить серьезную конкуренцию уже существующим лекарствам [8].
Уже в конце 2019 года компания Roche планирует подать документы на одобрение препарата в FDA и EMA (Европейское медицинское агентство) [13].
Сегодня «Золгенсма» является одним из немногих одобренных генотерапевтических препаратов, и единственный — для лечения СМА. Данная технология является чрезвычайно перспективной и теоретически может подарить шанс СМА-пациентам на продолжительную жизнь высокого качества. Однако возможные побочные эффекты и высокая стоимость препарата пока не позволяют делать поспешных радужных выводов.
- Сокольник В.П. (2012). От молекулярных основ СМА к разработке терапевтической стратегии. «Медицинский журнал». 3, 115–118;
- Генетические основы спинально-мышечной атрофии. «Семьи СМА»;
- Надежда для СМАйликов;
- Есть ли смысл в антисенсах?;
- «Биоген» открывает программу расширенного доступа к препарату «Спинраза» в России. (2019). «Семьи СМА»;
- Novartis enters agreement to acquire AveXis Inc. for USD 8.7 bn to transform care in SMA and expand position as a gene therapy and Neuroscience leader. (2018). Novartis Global;
- SMA: report-at-a-glance. (2019). ICER;
- Фон Ройсс Т. (2019). «Золдженсма»: генная терапия, которая вылечит спинальную мышечную атрофию. Все подробности. «Мосмедпрепараты»;
- Luxner L. (2019). With Zolgensma’s approval, debate shifts to pricing and availability of world’s costliest drug. SMA News Today;
- Marks P. (2019). Statement on data accuracy issues with recently approved gene therapy. FDA;
- Дмитриев Р. (2019). «Байоджен» попытается усилить терапевтическую эффективность «Спинразы». «Мосмедпрепараты»;
- Media release. (2019). Roche;
- Новые данные о планах по регистрации досье на препарат «Рисдиплам» для лечения СМА. (2019). «Семьи СМА»;
- Компания Janssen будет работать над обеспечением доступа российских пациентов к препарату для лечения спинальной мышечной атрофии. (2018). «Семьи СМА».
Не стоит она слезинки хотя бы одного только того замученного ребёнка,
который бил себя кулачонком в грудь и молился в зловонной конуре
неискуплёнными слезами своими к «боженьке».
Ф. М. Достоевский, «Братья Карамазовы»
В конце мая 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило «Золгенсма» (Zolgensma, онасемноген абепарвовек) — генную терапию спинальной мышечной атрофии с биаллельной мутацией гена выживаемости моторных нейронов 1 (SMN1) у детей в возрасте младше двух лет. Препарат подходит как симптоматическим пациентам, так и предсимптоматическим, выявляемым генетическим тестированием. Разрешение выдано «Авексис» (AveXis), которую «Новартис» (Novartis) купила за 8,7 млрд долларов.
В середине мая 2020 года Европейское агентство по лекарственным средствам (EMA) наделило «Золгенсма» маркетинговым разрешением для лечения пациентов со спинальной мышечной атрофией (генетический дефект в хромосомном плече 5q) с биаллельной мутацией гена SMN1 и либо клиническим диагнозом спинальной мышечной атрофии типа I, либо наличием гена SMN2 в количестве до трех копий.
Ключевое преимущество «Золгенсма» перед любыми иными фармакологическими подходами к терапии спинальной мышечной атрофии заключено в возможности полного излечения заболевания — после однократного введения препарата. Во всяком случае на это можно смело рассчитывать, если исходить из фундаментальных принципов генной терапии.
Однако следует четко понимать, что, во-первых, благотворный эффект «Золгенсма» будет проявляться постепенно и, во-вторых, «Золгенсма» не обращает вспять нарушения, уже вызванные болезнью. Другими словами, могут сохраниться некоторые признаки и симптомы спинальной мышечной атрофии, такие как трудности с глотанием и дыханием, мышечная слабость.
Поскольку спинальная мышечная атрофия приводит к прогрессирующему и необратимому повреждению моторных нейронов, польза от применения «Золгенсма» зависит от степени тяжести заболевания на момент лечения. И потому, очевидно, имеет смысл организовывать лечение подходящих пациентов при помощи «Золгенсма» с первых дней их жизни. При этом несмотря на тот факт, что пациенты с симптоматической спинальной мышечной атрофией на поздних стадиях вряд ли достигнут такого же развития общей моторики, как здоровые сверстники без этой болезни, они всё равно извлекут определенную клиническую пользу от генной терапии.
«Новартис» установила цену на «Золгенсма» в размере 2,125 млн долларов за дозу — достаточно одного раза, да и повторные применения не рекомендованы во избежании иммунных реакций. Столь внушительный ценник сделал «Золгенсма» самым дорогим лекарственным средством на планете. К слову, ранее «Новартис» заявляла, что разумная стоимость препарата укладывается в пределы 4,6–5,4 млн долларов.
Можно подумать, что швейцарский фармгигант включил политику невероятной жадности, однако всё тщательно подсчитано. Компания из Базеля исходила из фармакоэкономической модели эффективности затрат, накапливающихся за десять лет лечения, отдача от которого проявляется в добавленных годах жизни с поправкой на ее качество при таком серьезном, инвалидизирующем и смертоносном заболевании, как спинальная мышечная атрофия.
«Новартис», занимаясь ценообразованием «Золгенсма», отталкивалась от того факта, что стоимость новинки должна быть вполовину меньше затрат на 10-летний курс терапии спинальной мышечной атрофии при помощи «Спинразы» (Spinraza, нусинерсен). До сего момента это было единственное лекарство авторства «Байоджен» (Biogen) и «Айонис фармасьютикал» (Ionis Pharmaceuticals), одобренное при данном заболевании. С учетом того, что первый год лечения нусинерсеном обходится в 750 тыс. долларов, а каждый последующий — в 325 тыс. долларов, за десять лет назначения «Спинразы» придется выложить 4,125 млн долларов.
«Новартис» работает над реализацией программы, которая позволит, во-первых, выплачивать астрономическую сумму в рассрочку в течение пяти лет — по 425 тыс. долларов ежегодно, и, во-вторых, прекращать оплачивать лечение, если оно вдруг перестало эффективно срабатывать.

В странах с развивающейся экономикой вроде России, где расходы на оборону и безопасность многократно превышают дотации на здравоохранение, пациентам остается уповать на милость государства, чтобы оно равно как договорилось с «Новартис» о предоставлении скидок, так и выделило бюджет на закупку «Золгенсма». Ну или придется собирать деньги по крохам всем миром. Вряд ли швейцарская фармацевтическая корпорация сойдет с ума, занявшись благотворительностью.
С января 2020 года «Новартис» приступила к бесплатной раздаче «Золгенсма». Для того чтобы получить генотерапию даром, врач, курирующий подходящего для лечения пациента, должен подать соответствующую заявку. Каждые две недели будет проводиться отбор на случайной основе: кому повезет, тому препарат достанется безо всякой оплаты. В лотерее могут участвовать пациенты из любой страны мира, где «Золгенсма» еще официально не одобрен.
В течение 2020 года швейцарский фармгигант намеревается наделить безвозмездной генотерапией «Золгенсма» максимум сто человек. Ограничение связано, как заявлено, с производственными мощностями: в настоящее время препарат выпускается на одной площадке, которая должна равно как удовлетворять растущий спрос на лечение ввиду ожидаемого появления «Золгенсма» в других странах, так и обеспечивать его бесперебойные поставки для клинических испытаний. «Новартис», которая планирует запуск еще двух производственных площадок, обещает следовать благотворительной программе длительное время, постепенно наращивая количество бесплатно раздаваемых доз «Золгенсма».
В 2021 году лотерея с бесплатным доступом к генной терапии «Золгенсма» продолжилась: выиграть курс лечения могут максимум сто человек.
Согласно подсчетам Института клинико-экономической экспертизы (ICER), разумная стоимость «Золгенсма» укладывается в диапазон 310–900 тыс. или находится в пределах от 710 тыс. до 1,5 млн долларов — в зависимости от какой методологии оценки отталкиваться: качества жизни с учетом прожитых лет (QALY) или добавленных лет жизни (LYG).
После одобрения «Золгенсма» и публикации ее результативности в случае предсимптоматических пациентов и больных спинальной мышечной атрофией типа II, специалисты ICER изменили оценку разумной стоимости генной терапии, повысив ее планку до 1,1–1,9 млн долларов (QALY) и 1,2–2,1 млн долларов (LYG). Таким образом, экспертное мнение по верхней границе сошлось с ценовым предложением «Новартис».
Как работает «Золгенсма»
Спинальная мышечная атрофия — группа редких (9,1 случай на 100 тыс.) генетических заболеваний, характеризующихся прогрессирующей дегенерацией спинного мозга и моторных нейронов ствола мозга, что отражается гипотонией, атрофией скелетных мышц и общей слабостью. Патология вызывается потерей или дисфункцией (делецией, перестройкой или мутацией) в гене выживаемости моторных нейронов 1 (SMN1). Почти все пациенты (95–98%) гомозиготны по дефектному гену SMN1, то есть оба родителя являются носителями рецессивного генетического нарушения.
Онасемноген абепарвовек (onasemnogene abeparvovec, AVXS-101) представляет собой генно-терапевтическое лечение, после единственной внутривенной дозы обеспечивающее замену отсутствующего или дефектного гена SMN1 на его функциональную копию. Итогом становится нормальная выработка белка выживаемости мотонейронов (SMN) — и соответствующее исцеление спинальной мышечной атрофии.
Генотерапия при помощи онасемногена абепарвовека предполагает аденовирусную доставку в организм трансгена SMN, кодирующего полностью функциональный белок SMN и встраивающегося в ядра моторных нейронов. Благодаря способности онасемногена абепарвовека пересекать гематоэнцефалический барьер с последующей трансдукцией клеток-мишеней подтверждена экспрессия SMN в мотонейронах во всех отделах головного и спинного мозга. Использование энхансера цитомегаловируса и куриного бета-актина в качестве гибридного промотора определяет быструю и устойчивую экспрессию SMN.

Капсид нереплицирующегося рекомбинантного аденоассоциированного вирусного вектора серотипа 9 (AAV9) служит для переноса функциональной копии гена выживаемости мотонейронов (SMN), причем минуя гематоэнцефалический барьер.

Стабильный трансген полностью функционального гена SMN встраивается в ядра моторных нейронов.

Трансген SMN представлен самокомплементарной двухцепочечной молекулой, обеспечивающей быстрое наступление эффекта. Обычный одноцепочечный AAV-вектор должен ждать клеточно-опосредованного синтеза комплементарной цепи ДНК для формирования двух цепей, необходимых для последующих транскрипции и синтеза белка.

Использование гибридного промотора, составленного из энхансера цитомегаловируса и куриного бета-актина, определяет непрекращающуюся и стабильную экспрессию SMN.
Оценка биораспределения трансгенных ДНК и мРНК и белка SMN, осуществленная цифровой капельной полимеразной цепной реакцией (ddPCRTM), полимеразной цепной реакцией с обратной транскрипцией (RT-PCR) и иммуногистохимическим окрашиванием соответственно, выявила, что векторные геномы, РНК-транскрипты и SMN-белки обнаруживаются во всех изученных отделах спинного мозга, в том числе шейном, грудном, поясничном и крестцовом. Экспрессия SMN-белка в моторных нейронах спинного мозга установлена на уровне, схожем с таковым для тканей, не пораженных спинальной мышечной атрофией типа I.
Анализ холинацетилтрансферазы (ChAT), маркера моторных нейронов, засвидетельствовал изобилие последних, причем с нормальными размерами и формой.
В общем и целом доказано, что однократное внутривенное введение «Золгенсма» способно восстановить SMN-экспрессию в моторных нейронах, лишенных функционального гена SMN1. Онасемноген абепарвовек разработан с тем прицелом, что спинальная мышечная атрофия является моногенным заболеванием, то есть достаточно доставить в организм корректную копию проблемного гена, чтобы остановить прогрессирование патологии.
Клиническая эффективность «Золгенсма»
Эффективность «Золгенсма» в отношении педиатрических пациентов в возрасте не старше двух лет была изучена в двух клинических исследованиях (нерандомизированных, открытых, многоцентровых): продолжающихся STR1VE-US (NCT03306277) и завершившихся START (NCT02122952) — фазы III и I/IIa соответственно.
Клинические симптомы спинальной мышечной атрофии типа I участников дебютировали до наступления шестимесячного возраста. Генетическое тестирование испытуемых показало, что у всех присутствуют биаллельные делеции гена SMN1, есть две копии гена SMN2 и отсутствует модификация c.859G>C в экзоне 7 гена SMN2 (наличие таковой свидетельствует о легком фенотипе болезни). Исходный титр антител против AAV9 составлял ≤ 1:50. Все испытуемые получили одну внутривенную инфузию онасемногена абепарвовека.
Результативность терапии спинальной мышечной атрофии при помощи «Золгенсма», на основе которой регулятор вынес положительный вердикт, оценивалась двумя показателями. Во-первых, выживаемостью пациентов — как времени, прошедшего с рождения до либо смертельного исхода, либо необходимости в постоянной искусственной вентиляции легких (ИВЛ). Последняя подразумевает проведение инвазивной процедуры (трахеостомии) или дополнительной вентиляции легких на протяжении 16 часов и более ежедневно в течение 14 и более дней подряд при отсутствии острых обратимых осложнений или периоперационных изменений.
Во-вторых, улучшениями моторных навыков — согласно шкале младенческих нейромышечных заболеваний теста Детской больницы Филадельфии (CHOP INTEND), общий балл которой варьирует от 0 до 64 (больше — лучше) и которая оценивает способности контролируемых движений головой, перекатываться со спины на бок, стоять, ползать и т. п.
STR1VE-US
Клиническое испытание STR1VE-US (NCT03306277) включило 22 пациента, которым не требовалась неинвазивная ИВЛ и которые могли питаться перорально (парентеральное питание не требовалось). Исходный балл CHOP INTEND составлял усредненных 31,0 (18–47). Средний возраст больных — 3,9 месяца (0,5–5,9). Участники получили одну дозу «Золгенсма» в количестве 1,1×1014 вирусных геномов на килограмм (вг/кг).
Март 2019 года
На дату начала марта 2019 года клинические результаты следующие:
- 91% пациентов (n=20/22) оставались в живых: один скончался (в возрасте 7,8 месяца) из-за дыхательной недостаточности, не связанной с генотерапией, второй вышел из эксперимента (в возрасте 11,9 месяца) и на момент отказа от исследований требовал постоянной ИВЛ.
- 70% респондентов (n=14/20) достигли 14-месячного возраста без необходимости в постоянной ИВЛ.
- Для справки: согласно естественной динамике спинальной мышечной атрофии типа I, лишь четверть пациентов переходят 14-месячный порог выживаемости без нужды в постоянной ИВЛ.
- Генотерапия «Золгенсма» засвидетельствовала существенное улучшение моторных функций, начиная уже с первого месяца после введения препарата.
- Рост балла CHOP INTEND составил в среднем 6,9; 11,7 и 14,3 пункта — по прошествии соответственно одного, трех и пяти месяцев после введения «Золгенсма».
- 95% пациентов (n=21/22) вышли к клинически значимым 40 баллам и больше по шкале CHOP INTEND, у 50% (n=11/22) этот балл составил минимум 50, а у 9% (n=2/22) достиг 60 и выше.
- Для сравнения: согласно естественному течению спинальной мышечной атрофии типа I, у детей в возрасте 6 месяцев или старше никогда не отмечается и не сохраняется балл CHOP INTEND на уровне 40 пунктов или выше. Более того, в период 6–12 месяцев фиксируется снижение на усредненных 10,7 балла.
- Улучшения моторных навыков на момент среднего возраста 11,9 месяца (9,2–16,9) таковы:
- самостоятельное удержание головы минимум 3 секунды: 80% пациентов (n=16/20) [два участника могли это делать до начала генотерапии, потому были исключены из анализа];
- способность перекатываться со спины на бок: 41% (n=9/22);
- способность сидеть без сторонней поддержки минимум 30 секунд: 50% (n=11/22);
- способность стоять со сторонней помощью: 5% (n=1/22);
- способность ползать: 5% (n=1/22);
- способность самостоятельно вставать и затем стоять без сторонней поддержки: 5% (n=1/22).
Май 2019 года
Дальнейшие наблюдения засвидетельствовали, что на конец мая 2019 года 83% пациентов (n=5/6) из достигших 18-месячного возраста смогли сидеть самостоятельно минимум 30 секунд, а один больной научился стоять и ходить при поддержке.
START
Клиническое испытание START (NCT02122952) вовлекло 15 пациентов, получивших либо низкую дозу препарата (n=3), либо высокую (n=12). Низкая доза составляла приблизительно треть от высокой, которая, в свою очередь, не поддается точной оценке ввиду, как впоследствии выяснилось, некорректной методике измерения концентрации «Золгенсма», а также ее снижения в течение времени хранения. Предположительно, низкая доза находилась в пределах 4,3–4,6×1013 вг/кг, а высокая — в диапазоне 1,1–1,4×1014 вг/кг. В когорте низкой дозы средний возраст участников составлял 6,3 месяца (5,9–7,2), высокой дозы — 3,4 месяца (0,9–7,9).
По истечении 24 месяцев наблюдений данные по когорте высокой дозы следующие:
- Все пациенты оставались в живых без нужды в постоянной ИВЛ.
- Для справки: согласно естественной динамике спинальной мышечной атрофии типа I, до двухлетнего возраста доживают только 8% больных, не нуждающихся в постоянной ИВЛ.
- Генотерапия «Золгенсма» засвидетельствовала существенное улучшение моторных функций, начиная уже с первого месяца после введения препарата. Важное наблюдение: динамика улучшений коррелировала с возрастом — чем раньше было осуществлено лечение, тем увереннее и быстрее восстанавливались моторные функции, причем несмотря на исходно низкой балл CHOP INTEND.
- Исходный усредненный балл CHOP INTEND в 28,2 пункта вырос до 49,6; 53,6 и 55,5 — соответственно по прошествии 6, 12 и 24 месяцев после лечения. 92% пациентов (n=11/12) вышли к клинически значимому баллу CHOP INTEND ≥ 50.
- Улучшения моторных навыков таковы:
- самостоятельное удержание головы минимум 3 секунды: 92% пациентов (n=11/12);
- способность перекатываться со спины на бок: 75% (n=9/12);
- способность сидеть без сторонней поддержки минимум 5 секунд: 92% (n=11/12);
- способность сидеть без сторонней поддержки минимум 10 секунд: 83% (n=10/12);
- способность сидеть без сторонней поддержки минимум 30 секунд: 75% (n=9/12);
- способность стоять со сторонней помощью: 17% (n=2/12);
- способность стоять самостоятельно: 17% (n=2/12);
- способность ходить со сторонней помощью: 17% (n=2/12);
- способность ходить самостоятельно: 17% (n=2/12).
- 60% пациентов (n=6/10), которым изначально не требовалась регулярная поддерживающая двухфазная вентиляция легких с положительным давлением (BiPAP), сохранили данный статус.
- 86% пациентов (n=6/7), изначально не получавших парентеральное питание сохранили данный статус. Только одному больному пришлось временно проводить кормление через зонд ввиду заживления раны в ходе тяжелого восстановительного периода после операции по поводу сколиоза. 80% пациентов (n=4/5), находившихся на парентеральном питании, смогли перейти на стандартное пероральное кормление.
- Назначение «Золгенсма» обеспечило устойчивую поддержку бульбарных функций: 92% пациентов (n=11/12) могли говорить, глотать и питаться перорально.
- Все участники столкнулись с распространенными в детском возрасте респираторными заболеваниями, которые, однако, в случае спинальной мышечной атрофии типа I обычно заканчиваются трахеостомией или смертью. Между тем все пациенты успешно перенесли соответствующую госпитализацию без трахеостомии или необходимости в постоянной ИВЛ.
Март 2019 года
На начало марта 2019 года, по прошествии почти четырех лет наблюдений за согласившимися (n=10) на это участниками из когорты высокой дозы, все (n=10/12) оставались в живых и не требовали постоянной ИВЛ или нутритивной поддержки. Среднее время с момента назначения «Золгенсма» составило 3,7 года (3,3–4,3), а средний возраст пациентов — 3,9 года (3,4–4,8). У всех больных сохранились полученные ранее моторные навыки. Два из четырех человек, которым ранее требовалась поддерживающая BiPAP, отказались от нее.
Май 2019 года
На конец мая 2019 года, когда среднее время после генотерапии составило 3,9 года (3,5–4,6), а средний возраст пациентов — 4,2 года (3,7–5,0), все больные из наблюдаемой когорты высокой дозы (n=10/10) оставались в живых, продолжая демонстрировать улучшение физических навыков. Два пациента, ранее никогда не получавших нусинерсен, научились стоять со сторонней поддержкой. 70% пациентам (n=7/10) более не назначают дополнительное лечение нусинерсеном. 60% пациентам (n=6/10) не требуется поддерживающая BiPAP.
Декабрь 2019 года
На конец декабря 2019 года, по прошествии усредненных 4,5 года (4,1–5,2) после введения «Золгенсма», когда средний возраст пациентов в когорте высокой дозы препарата составил 4,8 года (4,3–5,6), все участники (n=10/10), согласившиеся участвовать в долгосрочных клинических наблюдениях (LT-001), оставались в живых и не требовали постоянной искусственной вентиляции легких.
Приобретенные по завершении START моторные навыки сохранились у всех больных, из них 20% пациентов (n=2/10) обрели навык стоять с поддержкой, притом что никто из не получал дополнительно «Спинразу».
Среди прочих достижений: 60% (n=6/10) не получали никаких других препаратов, изменяющих течение спинальной мышечной атрофии; столько же участников не обращались к регулярной ежедневной кислородной поддержке.
Июнь 2020 года
На начало июня 2020 года все пациенты (100%, n=10/10) из долгосрочных наблюдений LT-001 оставались в живых и не требовали постоянной искусственной вентиляции легких.
Средний возраст пациентов составлял 5,2 года (4,7–6,1), а среднее время, прошедшее после введения «Золгенсма», — 5,0 года (4,6–5,6).
STR1VE-EU
Клиническое испытание STR1VE-EU (NCT03461289) фазы III (нерандомизированное, открытое, многоцентровое) пригласило пациентов (n=33) со спинальной мышечной атрофией типа I, геном которых характеризовался биаллельной делецией или точечной мутацией гена SMN1 и наличием одной-двух копий гена SMN2. Возраст участников не должен был превышать 6 месяцев к моменту начала генно-терапевтического лечения.
Особенностью набора STR1VE-EU стало то, что тяжесть заболевания некоторых участников была существенно серьезнее, если сравнивать с пациентами в клинических исследованиях START (NCT02122952) и STR1VE-US (NCT03306277). Так, исходный балл CHOP INTEND составлял усредненных 27,6 (14–55), свыше четверти испытуемых (27%, n=9/33) находились на искусственной вентиляции легких (ИВЛ), а почти одна треть (30%, n=10/33) требовала парентерального питания.
Средний возраст испытуемых на момент введения «Золгенсма» — 4,1 месяца (1,8–6,0), средний возраст манифестации симптомов заболевания — 1,6 месяца, число копий гена SMN2 — 2.
Декабрь 2019 года
На дату конца декабря 2019 года, когда после введения «Золгенсма» прошло усредненных 10,6 месяца (1,8–15,4), а средний возраст пациентов составлял 14,6 месяца (6,9–18,6), без малого все (97%, n=31/32) оставались в бессобытийном статусе, включая 94% (n=30/32), достигших возраста 10,5 месяца, и 56% (n=18/32), добравшихся до возраста 13,6 месяца. Под событием в данном случае понималась необходимость либо в трахеостомии, либо дыхательной поддержке (посредством неинвазивной ИВЛ) на протяжении 16 и более часов ежедневно в течение 14 и более дней подряд при отсутствии острых обратимых осложнений, исключая периоперационную вентиляцию.
Для справки: при естественном течении спинальной мышечной атрофии типа I, оставляемой без какого-либо лечения, бессобытийная выживаемость к возрасту 10,5 и 13,6 месяца оказывается справедливой лишь для 50% и 25% младенцев.
Подавляющее большинство (92%) пациентов, которые изначально не нуждались в кислородной поддержке, либо сохранили данный статус, либо получали двухфазную вентиляцию легких с положительным давлением (BiPAP) в профилактических целях в период острых осложнений. Две трети (67%) получали пищу перорально, не нуждаясь в питательной поддержке, что свидетельствует о стабилизации (или остановке) прогрессирования спинальной мышечной атрофии.
Две трети (66%) испытуемых продемонстрировали моторные навыки, которые не фиксируются, если заболевание не лечить. Так, 25% (n=8/32) смогли самостоятельно находиться в сидячем положении в течении минимум 10 секунд (первичная конечная точка), 63% (n=20/32) обрели способность контроля над удержанием головы, 25% (n=8/32) научились переворачиваться со спины на бок, а у одного пациента получилось стоять, ползать и ходить при сторонней поддержке.
Усредненный рост балла CHOP INTEND составил: 5,9 пункта (по прошествии 1 месяца после введения «Золгенсма», n=31); 10,1 пункта (3 месяцев, n=29); 13,3 пункта (6 месяцев, n=27).
У 66% пациентов (n=21/32) прибавка балла CHOP INTEND вышла к 40 и более пунктам, у 38% (n=12/32) — к 50 и более.
Для справки: при нелеченной спинальной мышечной атрофии типа I больные почти никогда не добираются до балла CHOP INTEND в 40 и более пунктов.
Что касается профиля безопасности «Золгенсма», одному участнику (в возрасте 6,9 месяца) пришлось выйти из клинического испытания ввиду серьезного неблагоприятного события — гипоксически-ишемического поражения головного мозга и респираторного дистресс-синдрома, повлекшего за собой смертельный исход. Вскрытие показало, что генная терапия отношения к этому не имеет.
Буквально все испытуемые (97%, n=32/33) столкнулись с минимум одним побочным явлением, при этом генно-терапевтическое лечение стало причиной возникновения серьезных отрицательных реакций у 6 человек. У почти всех (88%, n=29/33) отмечался рост печеночных трансаминаз, который был купирован кортикостероидом преднизолоном. У 4 больных засвидетельствовано падение количества тромбоцитов ниже 75 тыс./мкл.
Вопросы безопасности «Золгенсма»
Инструкция по медицинскому применению «Золгенсма» снабжена «чернорамочным» предупреждением о рисках острого и серьезного поражения печени и повышения уровня аминотрансфераз, причем эта вероятность увеличивается при существующих печеночных нарушениях.
Кроме того, нет безоговорочных данных, как поведет себя организм пациента в случае повторных вливаний «Золгенсма». Считается, что отмеченный после инфузии высокий титр антител против вирусного вектора AAV9, как базы препарата, выступит серьезным препятствием для еще одной дозы генотерапии.
Назначение «Золгенсма» пациентам с запущенными формами спинальной мышечной атрофии (например, при полном параличе конечностей, постоянной зависимости от ИВЛ) не проверялось.
Среди самых распространенных побочных реакций на генотерапию «Золгенсма»: рост аминотрансфераз АЛТ и/или АСТ (27,3% пациентов), рвота (6,8%.)
«Золгенсма» и конкуренты
Появление первой генной терапии спинальной мышечной атрофии негативным образом отразится на доходах «Байоджен» от продажи «Спинразы» и роялти, которое получает «Айонис», основной разработчик этого антисмыслового олигонуклеотида. Нынешний заработок здесь приличен: если в 2017 году нусинерсен сгенерировал 884 млн долларов для «Байоджен», то в 2018-м — уже 1,7 млрд долларов.
Впрочем, инвесторам пока опасаться не следует, поскольку в настоящее время «Золгенсма» разрешен для лечения только младенческой формы спинальной мышечной атрофии — «Спинраза» пригоден для терапии всех пациентов, включая взрослых. Так, согласно экспертным оценкам, в Соединенных Штатах ежегодно ставится приблизительно 400 новых диагнозов спинальной мышечной атрофии — против где-то 7 тыс. пациентов всех возрастов и типов заболевания.
Серьезный конкурентный удар будет нанесен, когда случится одобрение рисдиплама (risdiplam) — модификатора альтернативного сплайсинга пре-мРНК гена SMA2, доводимого до кондиции «Рош» (Roche) и «ПиТиСи терапьютикс» (PTC Therapeutics). Во-первых, он предназначен для терапии всех типов спинальной мышечной атрофии. Во-вторых, его эффективность превосходит таковую для «Спинразы» и лишь немногим уступает результативности «Золгенсма». В-третьих, рисдиплам — пероральный низкомолекулярный препарат, то есть несложный в изготовлении и простой в применении и, скорее всего, не собирающийся заряжать гигантский ценник.
Если верить прогнозам EvaluatePharma, к 2024 году спрос на «Золгенсма» нагонит интерес к «Спинразе», причем продажи последнего будут постепенно снижаться, уступая дорогу главным образом рисдипламу.
«Золгенсма»: что дальше
«Новартис» пробует расширить список терапевтических показаний «Золгенсма», добавляя равно как предсимптоматических пациентов, так и с диагнозами более легких форм спинальной мышечной атрофии — типов II и III.
С недавних пор спинальная мышечная атрофия включена в список заболеваний, рекомендованных для скрининга на их наличие у всех новорожденных в Соединенных Штатах. Другими словами, «Новартис» может предлагать «Золгенсма» каждому пациенту с только что поставленным диагнозом. И это весьма важно ввиду чрезвычайно узкого по времени окна возможностей, предоставляющего высокие шансы на «реанимацию» полного набора моторных нейронов, которые быстро превращаются в дисфункциональные. Их гибель означает точку невозврата.
Если говорить о лечении спинальной мышечной атрофии у пациентов, которые уже достаточно длительное время живут с ней, пока решительно неясно, поможет ли им «Золгенсма». Возможно, критический порог потери моторных нейронов пройден, и даже генотерапия не спасет. Таким образом, сохраняется потребность в фундаментальных исследованиях, которые дадут начало альтернативным вариантам лечения для полностью симптоматических больных со спинальной мышечной атрофией.
SPR1NT
Продолжающееся клиническое испытание SPR1NT (NCT03505099) фазы III (нерандомизированное, открытое, многоцентровое, международное) привлекло предсимптоматических (без симптомов и признаков заболевания) пациентов в возрасте до 6 недель с биаллельной делецией гена SMN1 и двумя копиями гена SMN2 (когорта 1) или тремя копиями гена SMN2 (когорта 2) — соответственно тех, кому грозит диагноз спинальной мышечной атрофии типа I или II. Все участники получили одну внутривенную дозу «Золгенсма».
Первичная конечная точка была установлена возможностью самостоятельного сидения в течение минимум 30 секунд (когорта 1) или стояния без сторонней поддержки на протяжении хотя бы 3 секунд (когорта 2), фиксируемой соответственно до прошествия 18 или 24 месяцев после назначения «Золгенсма».
Вторичные конечные точки для когорты 1: бессобытийная (смертельный исход или необходимость в постоянной ИВЛ при отсутствии острых обратимых осложнений или периоперационных изменений) выживаемость (к возрасту 14 месяцев) и способность поддерживать массу тела на уровне 3-й процентили или выше (в соответствии с нормами ВОЗ), причем без нутритивной поддержки (в возрасте до 18 месяцев).
Вторичная конечная точка для когорты 2: способность самостоятельно ходить (к возрасту до 24 месяцев).
«Новартис» исходит из особенностей патогенеза спинальной мышечной атрофии: недостаточность белка SMN, как первопричины заболевания, не только отражается снижением моторных функций, но и приводит к избирательной смерти моторных нейронов. И как только последние исчезли, никакое лекарство не вернет их к жизни. Другими словами, к терапии следует приступать в самом раннем возрасте. Дополнительными доказательствами оправданности данного подхода служат результаты, собранные «Спинразой» в ходе лечения предсимптоматических пациентов.
Однако если пытаться назначать «Золгенсма» слишком рано, есть определенная вероятность столкнуться с биологическим барьером в лице переданным ребенку через плаценту материнским IgG-антителом против AAV9. Поскольку последний является диким несинтетическим вирусом, у большинства взрослых, включая матерей тех детей, которые больны спинальной мышечной атрофией, уже есть иммунитет против него в виде соответствующих антител, инактивирующих «Золгенсма». К счастью, материнские анти-AAV9-антитела присутствуют у плода лишь временно и характеризуются приблизительно трехнедельным периодом полувыведения. И всё же где-то у 5–10% младенцев в возрасте до шести месяцев титр антител против AAV9 превышает пороговый уровень 1:50, тем самым делая невозможным лечение, в том числе заблаговременное, при помощи «Золгенсма».
Сентябрь 2018 года
Согласно промежуточным данным на конец сентября 2018 года, инфузию «Золгенсма» получили 7 пациентов в возрасте 8–37 дней (медиана 12 дней, среднее 21 день) и исходным баллом CHOP INTEND в усредненных 41,7. Рост последнего составил в среднем 6,8 (n=4), 11,0 (n=3), 18,0 (n=3) и 22,5 (n=2) баллов — по прошествии 14 дней, одного, двух и трех месяцев.
Март 2019 года
На начало марта 2019 года все пациенты (n=18/18) оставались в живых и в бессобытийном статусе. Медиана длительности наблюдений — 5,4 месяца, медианный возраст — 6,1 месяца. Среди больных со спинальной мышечной атрофией типа I средняя прибавка балла CHOP INTEND получилась равной 8,9 пункта по прошествии одного месяца, а среднее увеличение балла по шкале Бейли-III для оценки крупной моторики составило 8,4 пункта по истечении двух месяцев. Все пациенты показали выход или сохранение CHOP INTEND на уровне 50 баллов, причем у четырех отмечены 60 баллов, а три достигли максимальных по этой шкале 64 баллов. Пациенты продемонстрировали соответствующие возрасту моторные навыки, в том числе два человека могли самостоятельно сидеть минимум 30 секунд, а один — стоять с поддержкой минимум 2 секунды.
Май 2019 года
На конец мая 2019 года генотерапию прошли 10 пациентов с двумя копиями SMN2, 12 больных — с тремя и один человек — с четырьмя. Все остаются в живых и не требуют постоянной ИВЛ. После шести месяцев наблюдений за когортами с двумя и тремя копиями SMN2 у всех отмечены нормальные глотательные функции и прием пищи через рот. В когорте с двумя копиями SMN2 назначение «Золгенсма» обеспечило выход к 50 баллам CHOP INTEND и выше, причем семь пациентов отметились не менее чем 60 баллами, включая пять участников, зафиксировавших максимальный балл 64. По итогам 60% пациентов (n=6/10) обрели способность самостоятельно сидеть без сторонней поддержки минимум 30 секунд — в среднем возрасте 7,6 месяца, а 30% больных (n=3/10) научились стоять с поддержкой — в среднем возрасте 10,1 месяца.
Декабрь 2019 года
На конец декабря 2019 года генно-терапевтический препарат «Золгенсма» получили 14 и 15 предсимптоматических пациентов — с соответственно двумя и тремя копиями гена SMN2. По прошествии в среднем 10,5 месяца (5,1–18,0) и 8,7 месяца (2,0–13,9) после одной дозы «Золгенсма» их средний возраст составил 11,2 месяца (6,0–18,6) и 9,7 месяца (3,3–15,1). Еще один человек располагал четырьмя копиями гена SMN2, но в анализ эффективности лечения его данные включены не были.
На указанную дату все больные оставались в живых и не требовали постоянной искусственной вентиляции легких. Все участники не нуждались в дополнительной питательной поддержке. У почти всех (97%, n=28/29) масса тела укладывалась в нормальный диапазон.
Половина (50%, n=7/14) пациентов с двумя копиями гена SMN2 и все (100%, n=15/15) испытуемые с тремя копиями гена SMN2 показали развитие крупных моторных навыков на уровне, схожем с таковыми у сверстников без спинальной мышечной атрофии.
У всех (100%, n=14/14) пациентов с двумя копиями гена SMN2 балл CHOP INTEND вырос до 50 и более, притом что у 86% (n=12/14) он оказался равным 60 и больше.
Моторные достижения пациентов с двумя копиями гена SMN2:
- 57% (n=8/14) смогли самостоятельно сидеть в течение минимум 30 секунд, причем 88% (n=7/8) из них добились этого в соответствующие своему возрасту сроки;
- 21% (n=3/14) обрели способность самостоятельно стоять в течение минимум 10 секунд, при этом 2 из 3 человек получили данный навык в соответствующие своему возрасту сроки;
- 29% (n=4/14) научились самостоятельно ходить, и 3 из 4 человек сделали это в соответствующие своему возрасту сроки.
Моторные достижения пациентов с тремя копиями гена SMN2:
- 27% (n=4/15) получили возможность самостоятельно стоять на протяжении минимум 3 секунд, и у всех (n=4/4) данная способность появилась в соответствующие своему возрасту сроки;
- 60% (n=9/15) смогли стоять при сторонней поддержке;
- 13% (n=2/15) начали самостоятельно ходить.
Июнь 2020 года
На начало июня 2020 года наблюдение за пациентами из двух когорт (n=14 и n=15), усредненный возраст которых составил 15,6 месяца (8,8–18,8) и 15,2 месяца (3,3–21,1), продолжилось. По прошествии в среднем 14,1 месяца (8,0–18,4) и 13,1 месяца (2,0–19,9) соответственно после однократного введения «Золгенсма» все больные оставались в живых и не требовали респираторной или питательной поддержки, а их клинические показатели улучшились.
Все пациенты (100%, n=14/14 и n=15/15) продемонстрировали устойчивую прибавку среднего балла по шкале Бейли-III для оценки мелкой и крупной моторики.
При этом у 64% (n=9/14) испытуемых с двумя копиями гена SMN2 и у 100% (n=15/15) с тремя копиями гена SMN2 улучшения крупной моторики оказались аналогичными тем, которые отмечаются у детей в том же возрасте без спинальной мышечной атрофии.
Моторные достижения пациентов с двумя копиями гена SMN2:
- 79% (n=11/14) смогли самостоятельно сидеть в течение минимум 30 секунд, причем 91% (n=10/11) из них добились этого в соответствующие своему возрасту сроки;
- 29% (n=4/14) обрели способность самостоятельно стоять в течение минимум 10 секунд, при этом 50% (n=2/4) из них получили данный навык в соответствующие своему возрасту сроки;
- 36% (n=5/14) научились самостоятельно ходить, и 80% (n=4/5) из них сделали это в соответствующие своему возрасту сроки;
- у всех (100%, n=14/14) балл CHOP INTEND достиг или сохранился на уровне 50 пунктов и более, притом что у 86% (n=12/14) он составил 60 и более.
Моторные достижения пациентов с тремя копиями гена SMN2:
- 53% (n=8/15) получили возможность самостоятельно стоять на протяжении минимум 3 секунд, и у всех (100%, n=8/8) данная способность появилась в соответствующие своему возрасту сроки;
- 40% (n=6/15) начали самостоятельно ходить, причем у всех (100%, n=6/6) указанный моторный навык был достигнут в соответствующие своему возрасту сроки;
- 80% (n=12/15) смогли стоять при сторонней поддержке, и 83% (n=10/12) сделали это в соответствующие своему возрасту сроки.
STRONG
Продолжается клиническое испытание STRONG (NCT03381729) фазы I/II (нерандомизированное, открытое, многоцентровое), изучающее эффективность и безопасность интратекального введения «Золгенсма» при спинальной мышечной атрофии типа II.
«Новартис» надеялась, что собранных в STRONG данных окажется достаточно для подачи заявки на расширение популяции пациентов, пригодных для лечения при помощи «Золгенсма». Однако в конце сентября 2020 года FDA истребовало проведения подтверждающего клинического исследования. В итоге регуляторный вердикт задержится, есть мнение, аж до 2023 года.
Внутривенное введение «Золгенсма», осуществляемое при спинальной мышечной атрофии типа I, как самой тяжелой формы этого нейромышечного заболевания, предполагает системную доставку генотерапии к моторным нейронам в головном и спинном мозге и другим локациям. В младенческом возрасте критически необходима должная экспрессия белка SMN по всему организму, включая периферические ткани.
Интратекальное введение подразумевает вливание лекарственного препарата в позвоночный канал или субарахноидальное пространство так, чтобы он достиг спинномозговой жидкости. В случае «Золгенсма» это оправданно при спинальной мышечной атрофии типа II или III, с которой сталкиваются, как правило, дети более старшего возраста, подростки и взрослые. Интратекальное введение организует более таргетное нацеливание препарата, когда основной мишенью выступают моторные нейроны на всём протяжении спинного мозга (включая шейный его отдел), а также в стволе и моторной коре головного мозга. И это представляет особой интерес для пациентов, поскольку указанные области контролируют мышцы, участвующие в произвольных движениях, дыхании и глотании. Кроме того, становится возможным назначать препарат в пониженной дозе, снижая риски иммунной реакции на вирусный вектор в периферических тканях.
В октябре 2019 года FDA поставило на частичную паузу клиническую программу, проверяющую интратекальное назначение «Золгенсма». Регулятор выказал обеспокоенность результатами доклинических исследований на животных: интратекальное введение онасемногена абепарвовека приводило к воспалению дорсальных корешковых ганглиев спинного мозга ввиду инфильтрации мононуклеарных клеток и иногда сопровождалось дегенерацией нейронных клеток или их потерей. В ответ на это «Новартис» предоставила данные по безопасности «Золгенсма», свидетельствующие об отсутствии клинических случаев сенсорной нейропатии у 335 пациентов, до конца 2019 года получивших онасемноген абепарвовек внутривенно или интратекально.
Участники STRONG, находящиеся в возрасте от 6 месяцев до 5 лет на момент начала лечения, должны были иметь способность сидеть минимум 10 секунд без сторонней поддержки, но не стоять или ходить. Среди обязательных критериев включения в исследование:
- три копии гена SMN2;
- гомозиготное отсутствие экзона 7 гена SMN1 (встречается у 95% пациентов с диагнозом спинальной мышечной атрофии: соответствующие аберрантные мРНК-транскрипты, лишенные экзона 7, кодируют усеченный и нестабильный белок SMNΔ7);
- отсутствие модифицирующей мутации c.859G>C в экзоне 7 гена SMN2 (наличие таковой свидетельствует о легком фенотипе болезни);
- манифестация клинических признаков и симптомов спинальной мышечной атрофии в возрасте до 12 месяцев.
Больные были распределены на две группы по возрасту начала лечения: от 6 месяцев до 2 лет (группа 1) и от 2 лет включительно до 5 лет (группа 2). Им назначались три различных дозы «Золгенсма»: доза A (6,0×1013 вг/кг), доза B (1,2×1014 вг/кг), доза C (2,4×1014 вг/кг).
Показатели эффективности лечения должны были сниматься по прошествии 12 месяцев после применения «Золгенсма». Первичная конечная точка для первой группы была заявлена способностью самостоятельно стоять минимум 3 секунды по шкале развития младенцев Бейли, для второй группы — изменением балла по расширенной шкале оценки двигательной функции Хаммерсмита (HFMSE). Вторичная конечная точка для обеих групп была установлена способностью самостоятельно проходить хотя бы 5 шагов с должными координацией и балансом по шкале Бейли.
Для пущего понимания эффективности «Золгенсма»: если спинальную мышечную атрофию типа II оставлять без какого-либо лечения, со временем показатель HFMSE неминуемо ухудшается, больные никогда не могут самостоятельно ходить и зачастую прикованы к инвалидному креслу; свыше 30% пациентов умирают к 25-летнему возрасту.
Март 2019 года
На начало марта 2019 года все пациенты (n=30), наблюдения за которыми велись в среднем 6,5 месяца, оставались в живых. У 19 участников отмечен рост балла HFMSE на усредненных 4,2 пункта. Два человека смогли стоять самостоятельно, один — ходить с поддержкой, еще один — ходить самостоятельно.
Май 2019 года
На конец мая 2019 года, когда одна из вышеуказанных доз «Золгенсма» была назначена 31 пациенту, результаты следующие:
- группа 1
- среди 16 пациентов, получивших дозу A или дозу B, зафиксированы 18 моторных достижений, в том числе такие, что 2 человека обрели возможность самостоятельно стоять, а один из них — самостоятельно ходить.
- группа 2
- при наблюдении на протяжении в среднем 9,3 месяца продемонстрирован рост балла HFMSE на усредненных 5,9 пункта, и это улучшение почти вдвое перешагнуло порог клинической значимости, установленный ростом балла HFMSE минимум на 3,0 пункта;
- половина пациентов (n=6/12) отметилась прибавкой HFMSE минимум на 3,0 пункта, засвидетельствованной в течение первого месяца после вливания «Золгенсма»;
- среди 12 испытуемых, получивших дозу B, зафиксированы 4 моторных достижения, включая обретение одним участником возможности ходить при сторонней поддержке.
Декабрь 2019 года
Собранные на начало декабря 2019 года результаты терапии при помощи «Золгенсма», охватывающие данные 32 пациентов, таковы (приведены сведения об участниках, получивших дозу B [n=25]):
- группа 1 (n=13)
- к первичной и вторичной конечным точкам эффективности лечения вышел один пациент;
- 83% пациентов (n=5/6), достигших возраста, приемлемого для проведения оценки по шкале HFMSE, показали рост на 3,0 балла, фиксируемый в любой временной промежуток после 24-месячного возраста, что соответствует достижениям в группе 2, охватившей более старших пациентов.
- 46% больных (n=6/13) продемонстрировали 18 моторных достижений, включая одного пациента, который смог самостоятельно стоять и ходить.
- группа 2 (n=12)
- достигнута первичная конечная точка эффективности лечения — относительно естественного течения заболевания, оставляемого без надлежащего лечения (p<0,0021);
- пациенты показали клинически значимое улучшение моторных функций, что отразилось ростом балла HFMSE на 6,0 пунктов — по прошествии 12 месяцев после назначения «Золгенсма»;
- при оценке в любой проверочный период почти все (92%) испытуемые (n=11/12) отметились клинически значимой прибавкой балла HFMSE минимум на 3,0 пункта, тем самым подтвердив устойчивый ответ на лечение и явное улучшение течения заболевания в сравнении с оставляемым без терапии (p<0,0001);
- три человека из получивших дозу B показали четыре моторных достижения, включая способность ходить при сторонней поддержке у одного испытуемого;
- возможность проходить хотя бы 5 шагов самостоятельно пока не наблюдалась ни у кого из участников.
REACH
Как только STRONG накопит должный массив данных, будет дан старт клиническому испытанию REACH фазы I, которое охватит пациентов в возрасте от 6 месяцев до 18 лет со спинальной мышечной атрофией типов I, II или III, не подходящих под критерии участия во всех других исследованиях «Золгенсма». Речь идет о тех больных, у которых титр антител против AAV9 выше 1:50. Интратекальное назначение генотерапии будет предваряться процедурой плазмафереза, которая устранит указанные антитела. Во всяком случае испытания на приматах подтвердили состоятельность плазмафереза в задаче избавления от вредных в данном случае анти-AAV9-антител.
Проблемы «Золгенсма»
Как бы то ни было, по-прежнему открытым остается вопрос с длительностью периода исцеления спинальной мышечной атрофии: проведенные клинические испытания всё же коротки, чтобы можно было безоговорочно заявлять о полном излечении, которое сохранится на протяжении всей жизни пациента. Не исключено, со временем экспрессия SMN будет снижаться, притом что повторить генно-терапевтическую процедуру не представляется возможным ввиду высокой вероятности формирования антител против капсидных белков аденовирусного вектора AAV9. Опять же, с взрослением ребенка фенотип спинальной мышечной атрофии может масштабироваться, поражая другие органы и ткани, а в настоящее время неизвестно, воздействует ли положительно генотерапия на клетки иных типов.
Инструкция по медицинскому применению лекарственного препарата «Золгенсма» (Zolgensma, онасемноген абепарвовек) в США. [PDF]
Инструкция по медицинскому применению лекарственного препарата «Золгенсма» (Zolgensma, онасемноген абепарвовек) в Европейском союзе. [PDF]
Отвечаем на самые частые вопросы о самом дорогом уколе от СМА
Помочь Фонду
Спинально-мышечная атрофия (СМА) — это наследственное нервно-мышечное заболевание, которое поражает двигательные нейроны спинного мозга, приводит к слабости мышц, их атрофии, и, в итоге, обездвиживанию пациента. Первыми слабеют мышцы тела, из-за чего человек теряет способность двигать руками, ногами, шеей, а затем недуг доходит до мышц, отвечающих за дыхание и глотание. При этом интеллект людей с СМА — сохранен.
Около 50 % детей с СМА первого типа (СМА-I) без лечения не доживают даже до двух лет. Заболевание проявляется в одном случае из 6–10 тысяч новорождённых — это самая частая из редких болезней.
Что такое Золгенсма и как он работает?
Золгенсма — это торговое наименование препарата швейцарской компании Novartis, который стал третьим из существующих в мире препаратов для лечения СМА и самым дорогим уколом в мире: его стоимость оценивается около 160 миллионов рублей. Золгенсма — единственный препарат для лечения спинально-мышечной атрофии, который до сих пор не зарегистрирован в России: он ожидает одобрения Минздрава РФ с июля 2020 года.
Главное его отличие от двух других лекарств от СМА — Спинразы и Рисдиплама — состоит в том, что терапия Золгенсмой подразумевает однократное введение препарата в организм, тогда как и Спинраза, и Рисдиплам принимают на протяжении всей жизни. Золгенсма заменяет отсутствующий или дефектный ген SMN1 на его здоровую копию. Это приводит к нормальной выработке белка и восстановлению работоспособности мышц.
Спинраза работает несколько иначе. Препарат увеличивает производство белка из «запасного» гена SMN2, что стабилизирует состояние тела, а отмирание нейронов спинного мозга прекращается. Спинраза вводят в спинномозговую жидкость.
В первый год лечения необходимо будет сделать 6 инъекций Спинразы. После этого препарат нужно будет применять постоянно в течение всей жизни каждые 4 месяца. Один укол Спинразы стоит от 5 до 9 миллионов рублей.
Рисдиплам (или Эврисди) — это единственный препарат для терапии СМА, который можно принимать на дому. Его употребляют один раз в день в жидкой форме либо перорально (через рот), либо через зонд для энтерального питания. Он напрямую воздействует на центральную и периферическую нервные системы, увеличивая активность белков. Одна ампула Рисдиплама стоит около 1 миллиона рублей.
Почему Золгенсма так дорого стоит?
Внештатный специалист по медицинской генетике Минздрава России Сергей Куцев рассказал информагентству РИА «Новости», что одной из причин столь высокой стоимости Золгенсмы является дороговизна разработки препарата. Если доклинический этап и эксперименты могут обойтись в несколько миллионов долларов, что немного для препарата, которое может за один укол излечить потенциально смертельное заболевание, то клинические исследования обходятся в сотни миллионов и миллиарды долларов. При этом число потребителей очень мало, и, чтобы разработка окупилась, создатели Золгенсмы ставят очень высокий ценник. Также стоимость увеличивается потому, что препарат в Россию можно только привезти из-за рубежа и что курс доллара к рублю постоянно растёт.
Один угол Золгенсма стоит порядка 160 миллионов рублей. В то же время один укол Спинразы стоит от 5 до 9 миллионов, а ампула Рисдиплама — около 1 миллиона. Но применять последние два препарата людям придётся на протяжении всей жизни, в отличие от одноразовой Золгенсмы. Поэтому один дорогостоящий укол — выгоднее своих альтернатив.
А это точно не мошенничество?
Лечение Золгенсмой находится под жёстким контролем компании «Novartis» на нескольких независимых уровнях: врачебном, экономическом и дистрибьюторском.
Без назначения врача и получения лицензии в клинике, которая будет вводить препарат, Золгенсма не будет предоставлен ни за какие деньги, какой бы ни была сумма. Всего четыре федеральные клиники в России имеют разрешение от производителя на ввод Золгенсмы.
Помимо этого деньги, поступающие на лекарство, отслеживаются в США, а специальная комиссия изучает их происхождение. Деньги признаются легальными только при госзаказе и официальном благотворительном сборе через лицензированный Минюстом благотворительный фонд, который проходит ежегодный аудит.
Поставщики, которые занимаются непосредственно доставкой лекарства, всегда по нескольку раз перепроверяют все данные. Все перечисленные факторы делают любые мошеннические схемы невозможными.
Что происходит с ребёнком после укола?
Лизе Краюхиной поставили укол Золгенсма в апреле 2020 года. После введения препарата у неё несколько дней была температура, девочка почти ничего не ела, однако уже спустя три дня родители увидели первые изменения. Ушла потливость, наладилась работа кишечника. Как сказала мама девочки, Алёна, «в глазах появилась жизнь».
Спустя девять месяцев Лиза уже могла держать голову прямо, мотать ей в стороны и поднимать вверх, чего до этого она никогда не делала. Назад голова уже не запрокидывалась. После занятий с родителями у Лизы получается полностью отрываться от спинки стула и держать спину прямо. Постепенно она научилась поднимать руки, сгибать их в локте и самостоятельно черпать еду ложкой.
Сейчас, в октябре 2021 года, Лиза уже уверенно держит голову, поворачивает ей, активно работает руками, поднимает ноги, лёжа на спине.
«Чтобы нарабатывать умение Лизы владеть телом, мы ходим три раза в неделю в бассейн, один раз к реабилитологу, на массажи и электролечение. В сентябре Лизе исполнилось три года. Во время постановки прививки даже ножку поднести ко рту не могла, как это делают детки, а сейчас для неё это не проблема. Она у нас набиралась сил целый год после укола. Пока мышцы напитаются белком, пока организм перестроится — всё это не быстрый процесс. Учитывая, что ребёнок первые годы жизни находился в регрессивном состоянии, сегодня мы воспринимаем любое движение, любое действие Лизы с большой радостью», — сказала мама Алёна.
Почему отечественные учёные не могут разработать похожий препарат и спасать детей бесплатно?
В январе 2021 года Владимир Путин подписал указ о создании государственного фонда «Круг добра», который должен поддерживать детей с тяжёлыми жизнеугрожающими и хроническими заболеваниями, в том числе редкими. За два месяца до этого, в ноябре 2020 года, Президентом РФ был подписан закон о повышении ставки НДФЛ с 13 % до 15 % на доходы более 5 миллионов рублей в год. В фонд «Круг добра» направляются те средства, которые были получены с повышения этого налога.
Потребность в лекарствах определяет экспертный совет «Круга добра» на основании полученных из регионов заявок. Причём подать такую заявку заявку может только лечащий врач по месту жительства. Медик должен передать документы в региональный Минздрав, а тот, в свою очередь, — в федеральный. Дальше заявление рассматривает экспертный совет фонда и выносит окончательное решение — какой закупать препарат.
Экспертный совет даёт добро на терапию Золгенсмы только в том случае, если другие препараты, Спинраза и Рисдиплам, «не помогают». Помимо этого потенциальный пациент, ребёнок, непременно должен быть определённого возраста. Например, пациентам со СМА I типа назначают укол в возрасте до 6 месяцев или с течением заболевания не более двух месяцев.
Есть ещё одна проблема: сложность выяснения патологии. Чтобы определить, что ребёнок болеет СМА, нужно проводить генетические тесты с самого младенчества. Всех рождённых детей не тестируют в обязательном порядке, а родителям до полугода сложно самим определить, что что-то с ребёнком не так.
В мае 2021 года среди родителей детей с СМА ходили слухи, что врачи вовсе не подают заявки в «Круг добра» на Золгенсму, потому что препарат не зарегистрирован в России и никто не хочет одобрять заявки на такое лекарство. После ряда общественных резонансов «Круг добра» начал закупать Золгенсму; на момент ноября 2021 года, как рассказали представители фонда, одобрено 17 заявок.
Сейчас российская компания BIOCAD занимается разработкой аналога Золгенсмы, которая также сможет за один укол избавить малышей от СМА. Генеральный директор BIOCAD Дмитрий Морозов в разговоре с корреспондентами телеканала «Санкт-Петербург» сказал, что отечественное лекарство будет значительно дешевле разработки «Novartis». Оно в любом случае не будет бесплатным, потому что разработка требует денег.
Доклинические исследования препарата планируют завершить уже в конце 2021 года. Тогда же создатели планируют получить разрешение на клинические исследования первой фазы, но когда будет уже итоговый препарат и как он будет распределяться — неизвестно.
Золгенсма®, 2,0 × 1013 вектор-геномов/мл, раствор для инфузии
Действующее вещество: онасемноген абепарвовек
▼ Лекарственный препарат подлежит дополнительному мониторингу, который способствует быстрому выявлению новых сведений о безопасности. Вы можете помочь, сообщая информацию о любых нежелательных реакциях, которые возникли в период применения лекарственного препарата (в том числе и о случаях его неэффективности). Способ сообщения о нежелательных реакциях описан в разделе 4 листка-вкладыша.
Перед приёмом препарата полностью прочитайте листок-вкладыш, поскольку в нём содержатся важные для Вас сведения.
- Сохраните листок-вкладыш. Возможно, Вам потребуется прочитать его ещё раз.
- Если у Вас возникли дополнительные вопросы, обратитесь к лечащему врачу Вашего ребёнка, работнику аптеки или медицинской сестре.
- Если у Вашего ребёнка возникли какие-либо нежелательные реакции, обратитесь к лечащему врачу Вашего ребёнка, работнику аптеки или медицинской сестре. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в разделе 4 листка-вкладыша.
Содержание листка-вкладыша
- Что из себя представляет препарат Золгенсма®, и для чего его применяют
- О чём следует знать Вам перед применением препарата Золгенсма® для Вашего ребенка
- Применение препарата Золгенсма®
- Возможные нежелательные реакции
- Хранение препарата Золгенсма®
- Содержимое упаковки и прочие сведения
1. Что из себя представляет препарат Золгенсма®, и для чего его применяют
Препарат Золгенсма® представляет собой геннотерапевтический препарат. Действующее вещество препарата, онасемноген абепарвовек, содержит генетический материал человека.
Показания к применению
Препарат Золгенсма® показан для применения у:
- пациентов со спинальной мышечной атрофией (СМА с биаллельной мутацией к гене SMN1 и клиническим диагнозом СМ А 1-го типа или
- пациентов со СМ А с биаллель ной мутацией гена SMN1 и не более чем с тремя копиями гена SMN2.
Способ действия препарата Золгенсма®
СМА развивается при наличии дефекта в гене или отсутствии гена, необходимого для производства незаменимого белка под названием белок «выживаемости двигательных нейронов» (SMN). Если в организме отсутствует белок SMN, происходит гибель нервов, контролирующих движения мышц (двигательных нейронов). Это приводит к ослаблению и атрофии мышц с последующей утратой способности к движению.
Препарат Золгенсма® доставляет в организм человека полностью функционирующую копию гена SMN, благодаря которой обеспечивается продукция белка SMN. Данный ген доставляется в нуждающиеся в нем клетки с помощью изменённого вируса (вирусного вектора), который не может вызвать заболевание у человека.
Если у Вас остались вопросы о том, как действует препарат Золгенсма®, или почему он был назначен, обратитесь к лечащему врачу Вашего ребёнка или другому медицинскому работнику.
2. О чём следует знать перед применением препарата Золгенсма®
Тщательно выполняйте рекомендации лечащего врача. Они могут отличаться от общей информации в этом листке-вкладыше.
Особые указания и меры предосторожности
Перед введением препарата Вашему ребёнку проведут анализы на наличие антител к вирусу, чтобы проверить, подходит ли ему/ей данный препарат.
Если что-то из перечисленного относится к Вашему ребёнку, сообщите об этом лечащему врачу или другому медицинскому работнику.
- Заболевания печени. При лечении препаратом Золгенсма® может развиваться иммунный ответ, вызывающий повышение уровня ферментов печени или в редких случаях приводящий к её повреждению. Повреждение печени может привести к серьёзным последствиям, включая печёночную недостаточность и смерть. Возможные признаки, на которые следует обратить внимание после введения препарата, включают рвоту, желтуху (пожелтение кожи или белков глаз) и снижение внимания. Немедленно сообщите врачу, если Вы заметили, что у Вашего ребёнка появляются какие-либо симптомы, указывающие на повреждение печени. Перед началом лечения препаратом Золгенсма® Вашему ребёнку будет проведён анализ крови для оценки функции печени. Кроме того, после введения препарата (в течение не менее 3 месяцев) будут проводиться контрольные анализы крови для исключения повышения уровня ферментов печени. Более подробная информация приведена в разделе 4.
- Инфекция (например, простуда, грипп или бронхиолит), развивающаяся у ребёнка до или после введения препарата Золгенсма®, может привести к более серьёзным осложнениям. Лица, осуществляющие уход, и лица, находящиеся в тесном контакте с пациентом, должны соблюдать правила профилактики инфекций (например, гигиена рук, респираторная гигиена/кашлевой этикет, ограничение потенциальных контактов). Признаки возможной инфекции включают кашель, свистящее дыхание, насморк, боль в горле и повышение температуры тела. В случае появления у Вашего ребёнка каких-либо симптомов, свидетельствующих об инфекции, до или после введения препарата Золгенсма® незамедлительно сообщите об этом лечащему врачу.
- Кровоподтёки или кровотечение после введения препарата Золгенсма®. Применение препарата Золгенсма® может снижать уровень тромбоцитов (тромбоцитопения). Как правило, это происходит в течение первых двух недель после введения препарата Золгенсма®. Перед началом лечения препаратом Золгенсма® Вашему ребёнку будет проведён анализ крови для определения уровня тромбоцитов. Кроме того, в течение определённого периода времени после лечения Вашему ребёнку будут проводиться регулярные анализы крови для контроля изменений уровня тромбоцитов. Более подробная информация приведена в разделе 4.
- Обратитесь за неотложной медицинской помощью, если у Вашего ребёнка отмечается склонность к образованию синяков, судороги (припадки) или уменьшение количества выделяемой мочи после введения препарата Золгенсма®. Нарушение свёртывания крови в мелких сосудах (тромботическая микроангиопатия) сопровождается снижением количества эритроцитов и клеток, участвующих в процессе свёртывания (тромбоцитов). Образование сгустков крови у Вашего ребёнка может повлиять на работу почек. Данное явление наблюдалось, как правило, в течение первых двух недель после введения препарата Золгенсма®. Перед применением препарата Золгенсма® Вашему ребёнку будет выполнен анализ крови для определения количества клеток крови (включая эритроциты и тромбоциты), а также уровня креатинина — показателя, который позволяет оценить функцию почек. Возможно, после введения препарата Золгенсма® врач Вашего ребёнка сочтёт необходимым провести анализ крови (для определения уровня тромбоцитов) и измерить артериальное давление. Более подробная информация приведена в разделе 4.
- После применения препарата Золгенсма® у Вашего ребёнка наблюдается сероватый/голубоватый цвет кожи, затруднённое дыхание, отёки конечностей или живота. Применение препарата Золгенсма® может вызывать повышение уровня специфического белка сердечной мышцы под названием «тропонин I», что является признаком поражения сердца. Перед началом лечения препаратом Золгенсма® Вашему ребёнку будет проведён анализ крови для определения уровня тропонина. Кроме того, в течение определённого периода времени после лечения Вашему ребёнку будут проводиться регулярные анализы крови для контроля изменений уровня тропонина I. Более подробная информация приведена в разделе 4.
Применение других лекарственных препаратов (взаимодействие с другими лекарственными средствами, включая вакцины и биологические препараты)
Сообщите лечащему врачу Вашего ребёнка или другому медицинскому работнику, если ребёнок принимает, недавно принимал или может принимать какие-либо другие лекарственные препараты, включая отпускаемые без рецепта.
- Преднизолон. В связи с введением препарата Золгенсма® Ваш ребёнок также будет получать препарат под названием «преднизолон» в течение определенного периода времени (см. также раздел 3). Преднизолон относится к группе глюкокортикостероидов, которые применяются для избегания возможного повышения уровня ферментов печени после введения препарата Золгенсма®. С этой целью врач назначит Вашему ребёнку преднизолон или другой глюкокортикостероид.
- Вакцинация. В связи с тем, что глюкокортикостероиды оказывают влияние на иммунную систему, лечащий врач Вашего ребёнка может счесть необходимым отложить проведение некоторых видов вакцинации во время лечения преднизолоном или другим глюкокортикостероидом. Если у Вас остались вопросы, обратитесь к лечащему врачу Вашего ребёнка или другому медицинскому работнику.
Если Вы не уверены в том, что препарат, который получает Ваш ребёнок, является одним из перечисленных выше, проконсультируйтесь с лечащим врачом Вашего ребёнка или другим медицинским работником.
Дополнительная информация для родителей/оказывающих уход лиц
СМА в поздней стадии
Препарат Золгенсма® может спасти жизнеспособные двигательные нейроны, однако не способен вернуть к жизни уже погибшие клетки. Лечение препаратом Золгенсма® особенно эффективно у детей с менее выраженными симптомами СМА (такими как отсутствие рефлексов или снижение мышечного тонуса), которые имеют достаточное количество жизнеспособных двигательных нейронов. Применение препарата Золгенсма® может быть неэффективно у детей с тяжёлой мышечной слабостью, проблемами с дыханием, потребностью в постоянной искусственной вентиляцией лёгких (ИВЛ) или нарушенной функцией глотания. Лечащий врач определит, может ли подойти данный препарат Вашему ребёнку.
Правила гигиены
После введения препарата Золгенсма® входящее в его состав действующее вещество может некоторое время выделяться из организма ребёнка с продуктами жизнедеятельности. Родителям и оказывающим уход лицам следует строго соблюдать правила гигиены рук в течение не менее 1 месяца после введения препарата Золгенсма®. Надевайте защитные перчатки при непосредственном контакте с физиологическими жидкостями Вашего ребёнка или продуктами жизнедеятельности, после чего тщательно мойте руки с мылом в тёплой проточной воде или обрабатывайте дезинфицирующим средством для рук на спиртовой основе. Для утилизации загрязнённых подгузников используйте одноразовые пакеты для мусора. Одноразовые подгузники можно утилизировать с обычными бытовыми отходами.
Перечисленные правила необходимо соблюдать по меньшей мере в течение 1 месяца после введения препарата Золгенсма®. Если у Вас остались вопросы, обратитесь к лечащему врачу Вашего ребёнка или другому медицинскому работнику.
Не применяйте препарат Золгенсма®:
- если у Вашего ребёнка аллергия на онасемноген абепарвовек или любые другие компоненты препарата (перечисленные в разделе 6 листка — вкладыша).
3. Применение препарата Золгенсма®
Препарат Золгенсма® будет введён Вашему ребёнку врачом или медицинским работником.
Доза препарата Золгенсма® измеряется в единицах, называемых «векторными геномами», и будет определена лечащим врачом с учётом массы тела ребёнка.
Рекомендуемая доза препарата Золгенсма® составляет 1,1 × 1014 векторных геномов на килограмм (кг) массы тела. Препарат будет вводиться ребёнку внутривенно (в вену) путём однократной (капельной) инфузии в течение приблизительно 1 часа.
Препарат Золгенсма® вводят только ОДИН раз.
За 24 ч до введения препарата Золгенсма® Ваш ребёнок также будет получать преднизолон (или другой глюкокортикостероид) через рот. Доза глюкокортикостероида также будет определена с учётом массы тела ребёнка. Рекомендуемая доза преднизолона составляет 1 мг/кг массы тела в сутки. Лечащий врач определит общую дозу глюкокортикостероида для Вашего ребёнка.
Ваш ребёнок будет получать глюкокортикостероид ежедневно в течение как минимум 2 месяцев после введения дозы препарата Золгенсма® или до тех пор, пока уровень ферментов печени не снизится до приемлемого уровня. Лечение глюкокортикостероидом прекращают путём постепенного снижения дозы. Врач расскажет, когда и как применение глюкокортикостероида будет прекращено.
Если у Вас остались вопросы, связанные с применением препарата Золгенсма® или преднизолона, Вы можете задать их лечащему врачу Вашего ребёнка или другому медицинскому работнику.
4. Возможные нежелательные реакции
Подобно всем лекарственным препаратам препарат Золгенсма® может вызывать нежелательные реакции, однако они возникают не у всех.
Некоторые нежелательные реакции могут быть серьёзными.
Незамедлительно обратитесь за медицинской помощью, если у Вашего ребёнка наблюдается один из перечисленных серьёзных побочных эффектов.
Часто: могут проявляться не более чем у 1 из 10 человек
- Кровоподтёки или кровотечения, сохраняющиеся дольше, чем обычно после травмы — возможные признаки снижения уровня тромбоцитов.
- Сероватый или голубоватый цвет кожи, затруднение дыхания (например, учащение дыхания, одышка), отёки конечностей или живота- возможные признаки проблем с сердцем.
С неизвестной частотой: частоту развития невозможно оценить на основании имеющихся данных
- Склонность к образованию синяков, судороги (припадки): уменьшение количества выделяемой мочи — возможные признаки тромботической микроангиопатии.
- Рвота, желтуха (пожелтение кожи или белков глаз) или снижение внимания — возможные признаки поражения печени (включая печёночную недостаточность).
Другие возможные побочные эффекты
Если у Вашего ребёнка отмечаются какие-либо другие побочные эффекты, сообщите об этом лечащему врачу Вашего ребёнка или другому медицинскому работнику. Могут развиваться следующие побочные эффекты.
Очень часто: могут проявляться более чему 1 из 10 человек
- Повышение уровня ферментов печени по результатам анализа крови
Часто: могут проявляться не более чем у 1 из 10 человек
- Рвота
- Лихорадка
Если Вы заметили какие-либо побочные эффекты, не указанные в данном листке- вкладыше, сообщите об этом лечащему врачу Вашего ребёнка или другому медицинскому работнику.
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, проконсультируйтесь с врачом. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в листке-вкладыше. Вы также можете сообщить о нежелательных реакциях напрямую (см. ниже). Сообщая о нежелательных реакциях, Вы помогаете получить больше сведений о безопасности препарата.
Российская Федерация
Адрес: 109074, Москва, Славянская площадь, д. 4, стр. 1
Федеральная служба по надзору в сфере здравоохранения Российской Федерации
Тел.: + 7 (495) 698-45-38, +7 (499) 578-02-30
Факс: +7(495) 698-15-73
Электронная почта: pharm@roszdravnadzor.gov.ru
Сайт: www.roszdravnadzor.gov.ru
5. Хранение препарата Золгенсма®
- Препарат следует хранить в недоступном для детей месте.
- Не используйте препарат после истечения срока годности, указанного на этикетке флакона и картонной упаковке.
- Флаконы транспортируют в замороженном виде (при температуре не выше минус 60 °C).
- После получения набор с препаратом следует немедленно поместить в холодильник с температурой 2-8 °C.
- Повторно не замораживать.
- Препарат Золгенсма® необходимо использовать в течение 14 дней с момента получения флаконов.
6. Содержимое упаковки и прочие сведения
По 5,5 или 8,3 мл раствора для инфузий в стерильный, бесцветный пластиковый флакон Crystal Zenith из циклоолефинового полимера объёмом 10 мл, укупоренный серой резиновой пробкой из хлорбутила, обкатанной алюминиевым колпачком с пластиковой отщёлкивающейся крышкой («flip-off» устройство) светло-зелёного цвета. На горлышке флакона расположен стикер с описанием маркировки флакона на русском языке.
Набор из 2–14 флаконов по 5,5 мл и/или 8,3 мл в картонную подложку для флаконов вместе с инструкцией по медицинскому применению в пачку картонную, на которую нанесён стикер.
Варианты конфигурации наборов:
|
Флакон объёмом 5,5 мл |
Флакон объёмом 8,3 мл |
|
0 |
2 |
|
2 |
1 |
|
1 |
2 |
|
0 |
3 |
|
2 |
2 |
|
1 |
3 |
|
0 |
4 |
|
2 |
3 |
|
1 |
4 |
|
0 |
5 |
|
2 |
4 |
|
1 |
5 |
|
0 |
6 |
|
2 |
5 |
|
1 |
6 |
|
0 |
7 |
|
2 |
6 |
|
1 |
7 |
|
0 |
8 |
|
2 |
7 |
|
1 |
8 |
|
0 |
9 |
|
2 |
8 |
|
1 |
9 |
|
0 |
10 |
|
2 |
9 |
|
1 |
10 |
|
0 |
11 |
|
2 |
10 |
|
1 |
11 |
|
0 |
12 |
|
2 |
11 |
|
1 |
12 |
|
0 |
13 |
|
2 |
12 |
|
1 |
13 |
|
0 |
14 |
Допускается наличие контроля первичного вскрытия.
Перечень вспомогательных веществ
Трометамин
Магния хлорид
Натрия хлорид
Полоксамер 188
Хлористоводородная кислота
Вода для инъекций
Несовместимость
Учитывая отсутствие исследований о лекарственной совместимости, данный препарат нельзя смешивать с другими.
Держатель регистрационного удостоверения
Новартис Фарма АГ / Novartis Pharma AG
Лихтштрассе 35, 4056 Базель, Швейцария / Ifichtstrasse 35, 4056 Basel, Switzerland
Производитель
Новартис Генные Терапии, Инк., США / Novartis Gene Therapies, Inc., USA
1940 ЮЭСДжи Драйв, г. Либертивилл, штат Иллинойс (IL) 60048 / 1940 USG Drive, Libertyville, Illinois 60048
За любой информацией о препарате, а также в случаях возникновения претензий следует обращаться к локальному представителю держателя регистрационного удостоверения:
Российская Федерация
ООО «Новартис Фарма»
125315 г. Москва, Ленинградский проспект, д. 70
тел.: +7 495 967 12 70
факс: +7 495 967 12 68
эл. почта: drug.safety russia@novartis.com
Данный листок-вкладыш пересмотрен
Прочие источники информации
Подробные сведения о препарате содержатся на веб-сайте Союза http://еес.eaeunion.org/
Председатель правительства Рф Михаил Мишустин сообщил о выделении дополнительных средств на закупку иностранных лекарств для детей с тяжелыми заболеваниями центральной нервной системы. Возможно, что таким препаратом станет лекарство для больных СМА. Одно из них уже признано самым дорогостоящим в мире.
Что такое спинальная мышечная атрофия?
Спинальная мышечная атрофия (СМА) – это редкое генетическое заболевание, вызванное мутацией в гене SMN1 (survival motor neuron 1). Недостаток белка, который кодируется этим геном, приводит к дисфункции и гибели моторных нейронов в стволе головного мозга и спинном мозге. Поскольку моторные нейроны управляют работой мышц, у детей со СМА I типа (наступление симптомов в возрасте 0-6 месяцев) прогрессирует мышечная слабость и атрофия, в среднем к 6 месяцам развивается паралич, а к 2 годам наступает смерть от респираторной недостаточности.
Существует несколько типов СМА в зависимости от тяжести заболевания. При СМА I типа (примерно 50% случаев) проявления наступают в первые месяцы жизни. СМА II-IV типа проявляются позднее и протекают несколько легче. Помимо гена SMN1, у большинства людей есть также ген SMN2. Часть продукта SMN2 дублирует функции SMN1, но большая часть этого белка нефункциональна. Если у человека несколько копий гена SMN2, то тяжесть СМА обычно легче, но не всегда.
По данным регистра пациентского фонда «Семьи СМА» в России более 900 пациентов со СМА, однако если экстраполировать данные других стран, их должно быть примерно 2500-3500, то есть налицо недостаточная диагностированность населения. Ситуация будет изменяться по мере внедрения пренатального скрининга и генной диагностики.
Что такое Золгенсма?
Золгенсма – это препарат генной терапии для лечения спинальной мышечной атрофии (СМА) с мутациями в обоих аллелях (вариантах, полученных от мамы и папы) гена SMN1 (94% пациентов с СМА). В США препарат одобрен у пациентов в возрасте до двух лет. Он представляет собой нормальную копию гена SMN1, встроенную в геном специального вируса (аденоассоциированный вирус 9 серотипа, AAV9).
Препарат вводится пациенту внутривенно один раз. AAV9 хорошо проникает в клетки многих органов и тканей, включая моторные нейроны, которые более всего страдают при СМА. ДНК вируса практически не встраивается в геном клетки, а находится в ядре в виде отдельной молекулы, что повышает безопасность терапии с точки зрения генотоксичности. В клетках начинает производиться нормальный белок SMN1, что должно благоприятно влиять на течение болезни.
Какое лечение существовало до появления Золгенсмы?
До одобрения Золгенсмы единственным препаратом, нацеленным на причину болезни, была Спинраза, одобренная в США в конце 2016 года. Она представляет собой относительно небольшую молекулу, которая способствует производству полностью функционального белка SMN2. Таким образом, у пациентов с геном SMN2 производится белок, дублирующий функции дефектного SMN1.
В клиническом исследовании у детей до двух лет, которое стало основанием для одобрения препарата, 61% детей были живы и независимы от постоянной вентиляции легких (32% — в контрольной группе). Улучшение моторных навыков наблюдалось у 51% пациентов (и ни одного в группе контроля). У детей 2-12 лет среднее улучшение через 15 месяцев терапии составило 3,9 пунктов по шкале моторных навыков, в то время как в контрольной группе наблюдалось ухудшение в среднем на 1 пункт.
Наиболее частыми нежелательными явлениями, ассоциированными со Спинразой, были инфекции дыхательных путей и запоры. Также наблюдался повышенный риск тромбоцитопении, нарушений свертывания крови и почечной токсичности.
В России Спинраза была зарегистрирована в начале 2019 года, благодаря программе расширенного доступа около 40 пациентов получили препарат от компании Biogen бесплатно. Сейчас далеко не все нуждающиеся в препарате его получают.
Какие клинические исследования были проведены с Золгенсмой?
На момент одобрения FDA (Управление по надзору за качеством пищевых продуктов и медикаментов США) в мае 2019 года были доступны данные по 36 пациентам с СМА I типа в возрасте от 0,5 до 7,2 месяцев. Из них трое получили низкую дозу препарата, а 33 – высокую. Из получивших высокую дозу 31 пациент на момент одобрения (4-28 мес. после начала терапии) не нуждался в постоянной вентиляции легких. 19 пациентов, получивших высокую дозу, были способны сидеть без поддержки. Это очень хорошие результаты, потому что без лечения в живых к этому моменту осталось бы примерно 8-9 пациентов, и сидеть не мог бы никто. По обновленным данным, опубликованным в сентябре 2019 года, максимальный срок наблюдения за пациентами составил 4,6 лет, некоторые из них начинают самостоятельно стоять и ходить.
Важно отметить, что чем раньше было начато лечение, тем лучше результаты. Так, все пациенты, которые хорошо ответили на лечение, были пролечены в возрасте до 4 месяцев. У тех, кто начал терапию позднее, результаты сопоставимы с теми, кто получал Спинразу.
Компания также ведет исследование на пациентах, у которых симптомы еще не наступили, они получили терапию в течение 6 недель после рождения. Все 22 пациента живы, не нуждаются в постоянной вентиляции легких и начинают стоять и ходить, что было бы невозможно при естественном течении болезни.
Во всех исследованиях Золгенсмы умерло два пациента по причинам, не связанным с терапией. У одного смерть произошла в результате легочной недостаточности, у другого – от мозговой ишемии, связанной с респираторной инфекцией. Еще один пациент вышел из исследования, так как ему требовалась постоянная легочная вентиляция.
Наиболее частыми нежелательными явлениями были рост печеночных ферментов и рвота. В одному случае у пациента наблюдалось острое повреждение печени.
В чем разница Спинразы и Золгенсмы?
- Золгенсма вводится один раз в жизни. Повторное введение будет неэффективно из-за того, что у всех пациентов после первого введения вырабатываются антитела к AAV9. Спинраза вводится 3 раза с интервалом в две недели, затем через месяц, затем каждые четыре месяца пожизненно.
- Золгенсма вводится внутривенно, Спинраза – интратекально (под оболочки спинного мозга).
- Золгенсма одобрена только у детей до двух лет и пока только в США, исследования у более старших детей ведутся. Спинраза одобрена как для детей, так и для взрослых.
- Результаты по эффективности Золгенсмы для детей со СМА I типа возрастом 1-4 мес. пока выглядят лучше, чем у Спинразы, но данные из разных исследований некорректно сравнивать. Золгенсма исследована на меньшем количестве пациентов и сравнительных исследованиях с ней не проводилось. С другой стороны, у Спинразы гораздо дольше опыт использования, и это пока единственный препарат, используемый у детей старше 2 лет.
- Профиль безопасности препаратов различается. Пациентам с нарушениями свертывания крови и почечными проблемами Спинраза, скорее всего, будет противопоказана. Золгенсма, вероятно, не будет рекомендована пациентам с печеночными проблемами.
Что у Золгенсмы с исследованиями на животных?
Исследования эффективности терапии проводились на мышах и свиньях. Было показано, что применение Золгенсмы приводит к улучшению моторных функций, нейромышечной проводимости, сердечной функции. Повышенные дозы Золгенсмы приводили к сердечной и печеночной токсичности.
В середине 2019 года компания Novartis, обладающая правами на Золгенсму, сообщила FDA, что часть данных на животных была подделана и этот факт компания скрыла при подаче документов на одобрение. Novartis обнаружила факт манипуляции за два месяца до подачи на одобрение, но решила не уведомлять о манипуляциях FDA, чтобы не задерживать одобрение препарата. Из ответа FDA ясно, что такая задержка бы действительно произошла, но сейчас одобрение отозвано не будет, потому что данные, с которыми производилась манипуляция, касаются предыдущей версии препарата и, таким образом, не влияют на эффективность и безопасность терапии, вышедшей на рынок.
В октябре 2019 года также стало известно, что при введении животным в спинной мозг Золгенсма может вызвать воспаление ганглиев дорсальных корешков. У людей такого эффекта пока не наблюдалось, но FDA на всякий случай приостановило текущее исследование по интратекальному введению Золгенсмы у пациентов старше 2 лет.
Какие еще препараты находятся в разработке?
Основной конкурент Золгенсмы и Спинразы – препарат Риcдиплам компании Roche: по нему опубликованы клинические данные, на основании которых компания подала на регистрацию в FDA. Согласно имеющимся данным, эффективность препарата превосходит эффективность Спинразы, и лишь немного уступает Золгенсме. Так, из 17 принимавших препарат пациентов через 12 месяцев в живых осталось 15. Пероральный прием и потенциально менее высокая стоимость (так как это низкомолекулярный препарат, а не вирусная конструкция) делает Рисдиплам привлекательной опцией для пациентов.
Профиль нежелательных явлений в исследованиях Рисдиплама в целом соответствовал тому, что можно ожидать для пациентов такого возраста, поэтому пока он проявляет себя как достаточно безопасный.
Подача документов на регистрацию Ридисплама в России ожидается в первом квартале 2020 года.
Ряд других препаратов находится на более ранних стадиях исследований.
Сколько стоят препараты?
Компании при определении цены новых препаратов ориентируются не на себестоимость (хотя в случае Золгенсмы она довольно высока и составляет $150 000 — $200 000), а на эффект, который терапия оказывает на пациентов и здравоохранение в целом.
Стоимость первого года лечения Спинразой установлена компанией Biogen в США в $750 000, последующих – в $325 000. В Европе цены примерно в полтора раза ниже, и государственные плательщики договариваются о дальнейшем снижении стоимости. На Золгенсму Novartis объявила цену в США $2,125 млн за одну инъекцию, что позволяет называть ее самым дорогостоящим лекарством в мире.
Novartis исходила из того, что уже через 5 лет стоимость лечения Спинразой превзойдет стоимость Золгенсмы. Однако надо заметить, что период наблюдения за пациентами пока слишком мал, чтобы говорить о долговременном превосходстве Золгенсмы. Компания готова сотрудничать с государственными и частными страховыми системами в разных странах над схемами оплаты препарата, чтобы сделать его доступным для пациентов.
Между тем, по подсчетам Института клинических и экономических обзоров США (ICER) Спинраза не должна стоить дороже $72 000 за годовой курс, а Золгенсма — $1,5 млн за инъекцию.
В декабре 2019 Novartis объявила, что раздаст 100 доз Золгенсмы бесплатно, используя принцип лотереи. Европейское пациентское сообщество SMA Europe подвергло компанию критике, упрекнув в неэтичности такого решения. Компания начала работу над улучшением выбранного подхода.
Материал подготовлен в рамках совместного проекта с сайтом о науке «Биомолекула«
Автор благодарит Ольгу Германенко, учредителя и директора фонда «Семьи СМА» за помощь в работе над текстом
Поскольку вы здесь…
У нас есть небольшая просьба. Эту историю удалось рассказать благодаря поддержке читателей. Даже самое небольшое ежемесячное пожертвование помогает работать редакции и создавать важные материалы для людей.
Сейчас ваша помощь нужна как никогда.